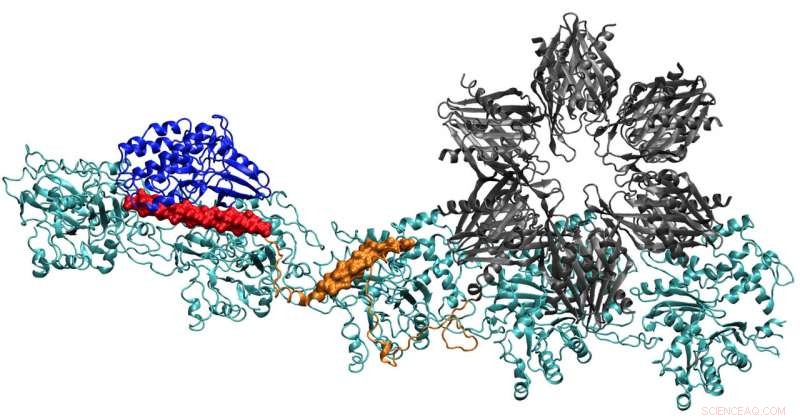
Un modèle de la protéine CaMKII montre de multiples domaines qui lui permettent de lier les filaments d'actine dans les dendrites des neurones en faisceaux, donnant leur forme aux dendrites. Chercheurs de l'Université Rice, l'Université de Houston et le Centre des sciences de la santé de l'Université du Texas à Houston pensent que le complexe est essentiel à la formation de la mémoire à long terme. Crédit :Wolynes Research Lab/Rice University
Une nouvelle pièce d'un puzzle difficile – la nature de la mémoire – s'est mise en place cette semaine avec un indice sur la façon dont les cellules du cerveau changent de structure lorsqu'elles apprennent quelque chose.
Interactions entre trois parties mobiles - une protéine de liaison, une protéine structurelle et le calcium - font partie du processus par lequel les signaux électriques pénètrent dans les cellules neurales et remodèlent les structures moléculaires censées permettre la cognition et le stockage des souvenirs.
Collègues de l'Université Rice, les théories combinées de l'Université de Houston (UH) et du Centre des sciences de la santé de l'Université du Texas à Houston (UTHealth), des simulations et des expériences pour déterminer comment une protéine de liaison centrale, la kinase II dépendante du calcium et de la calmoduline (CaMKII), se lie et se délie du cytosquelette d'un neurone.
Le rapport de l'équipe dans le Actes de l'Académie nationale des sciences donne les premiers détails clairs sur la façon dont les sites de liaison de CaMKII agissent pour aligner les filaments d'actine - la protéine structurelle - en long, faisceaux rigides. Les faisceaux servent de squelettes de soutien aux épines dendritiques, saillies hérissées qui reçoivent des messages chimiques via les synapses d'autres neurones.
Peter Wolynes, un physicien théoricien à Rice, rejoint une collaboration en cours entre la physicienne UH Margaret Cheung et le neurobiologiste UTHealth Neal Waxham qui visait à comprendre comment les signaux se frayent un chemin à travers les dendrites, les branches des cellules nerveuses qui transmettent l'information entre les cellules.
Trouver la structure complète de CaMKII s'est avérée trop complexe pour la cristallographie aux rayons X, même si certaines parties de sa structure étaient connues. Lorsqu'il est combiné avec l'actine qui constitue le cytosquelette, le système est également devenu la plus grande protéine que Wolynes et son équipe ont analysée via leur programme de prédiction de la structure des protéines, AWSEM.
Quand ils ont été faits, la structure prédite par l'ordinateur correspondait remarquablement aux images au microscope électronique à deux dimensions de Waxham et de son groupe qui montrent clairement que des filaments d'actine parallèles sont maintenus ensemble, en forme d'échelle, par des barreaux de CaMKII.
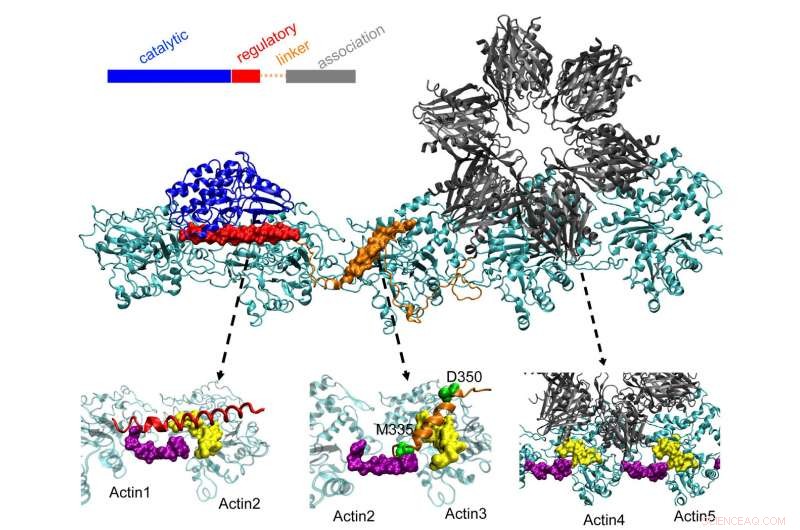
La protéine CaMKII au sommet des quais dans trois poches sur des filaments d'actine torsadés dans les neurones, un processus que les chercheurs de l'Université Rice, l'Université de Houston et le Centre des sciences de la santé de l'Université du Texas à Houston (UTHealth) estiment qu'il est important de former une mémoire à long terme. Le domaine régulateur (rouge) sur CaMKII se lie également aux protéines de calmoduline entrantes, qui décompressent toute la structure de l'actine et permettent aux filaments groupés de se réorganiser. Crédit :Wolynes Research Lab/Rice University
"Il y a certainement des étapes chimiques préliminaires impliquant l'activité enzymatique de CaMKII avant d'arriver à ce stade ; par conséquent, nous n'avons pas une idée très claire de la façon de tout assembler, ", a déclaré Wolynes. "Mais il est clair que l'assemblage du complexe est l'étape clé où la chimie se transforme en une structure à plus grande échelle pouvant contenir une mémoire."
CaMKII est particulièrement adapté pour interagir avec l'actine, la protéine la plus abondante dans les cellules eucaryotes et celle qui a des capacités spéciales dans les neurones, où il doit non seulement donner à des milliers de dendrites (dans chacun des milliards de neurones) leurs formes de repos, mais aussi leur donner un niveau de plasticité pour s'adapter à un barrage constant de signaux.
Les molécules d'actine s'auto-assemblent en longues, torsion des filaments. Les poches hydrophobes entre ces molécules sont parfaitement configurées pour lier CaMKII, une grosse protéine avec plusieurs parties, ou domaines. Ces domaines se bloquent sur trois sites de liaison consécutifs sur le filament, et les torsions mettent des sites de liaison à intervalles réguliers pour empêcher les protéines de s'accumuler.
Le domaine « d'association » de CaMKII est une sous-unité sextuple qui se lie également aux filaments adjacents pour former des faisceaux d'actine, les épines dorsales des épines dendritiques qui donnent leurs formes à ces protubérances.
Ces faisceaux restent rigides si la dendrite contient peu de calcium. Mais lorsque les ions calcium entrent par la synapse, ils se combinent avec des protéines de calmoduline, leur permettant de se lier à une autre partie de CaMKII, le domaine réglementaire des disquettes. Cela déclenche la dissociation d'un domaine de CaMKII du filament, suivi du reste de la protéine, ouvrant une courte fenêtre de temps pendant laquelle les bundles peuvent se reconfigurer.
"Quand suffisamment de calcium entre, la calmoduline activée brise ces structures, Mais seulement pendant un certain temps, " dit Wolynes. " Ensuite, le cytosquelette se reforme. Pendant ce temps, la colonne vertébrale dendritique peut prendre une forme différente qui pourrait être plus grande."
"Nous savons que le calcium apporte des informations dans la cellule, " Cheung a ajouté. "Mais comment les cellules nerveuses savent quoi en faire dépend vraiment de la façon dont cette protéine code l'information. Une partie de notre travail consiste à connecter cela au niveau moléculaire, puis à projeter comment ces règles géométriques simples développent des structures à plus grande échelle. »

Une image au microscope électronique montre des filaments d'actine maintenus ensemble dans des arrangements parallèles ou ramifiés par des protéines CaMKII dans un neurone. Simulations et expérimentations réalisées à Rice University, l'Université de Houston et le Centre des sciences de la santé de l'Université du Texas à Houston ont montré que l'espacement entre les particules CaMKII adjacentes dans les complexes est presque fixé à 36 nanomètres. La barre d'échelle est de 100 nanomètres. L'image a été réalisée au centre d'imagerie de biologie structurelle de la faculté de médecine McGovern de l'UTHealth. Crédit :Waxham Lab/UTHealth
Les calculs de l'équipe ont montré que le domaine d'association est responsable d'environ 40 % de la force de liaison de la protéine à l'actine. Un domaine de liaison ajoute 40 % supplémentaires et le domaine de régulation crucial fournit les 20 % finals :une stratégie sensée, puisque le domaine de régulation est à la recherche de calcium-calmodulines entrants qui peuvent décompresser la protéine entière du filament.
Le projet a été réalisé par le biais du Rice's Center for Theoretical Biological Physics (CTBP), dont Wolynes est co-directeur et Cheung un scientifique principal. Leur association remonte à l'époque où les deux étaient à l'Université de Californie, San Diego, lui en tant que professeur et elle en tant qu'étudiant diplômé du physicien Rice José Onuchic, également co-directeur du CTBP. Wolynes a également fait partie de son jury de thèse, elle a dit.
Cheung était au courant des travaux antérieurs de Wolynes et de son groupe Rice qui suggéraient que l'actine stabilise les fibres de type prion censées coder des souvenirs dans les neurones et a décidé que cela correspondait bien à ses recherches avec Waxham pour voir comment le calcium active CaMKII.
"C'est l'un des problèmes les plus intéressants des neurosciences :comment les changements chimiques à court terme mènent-ils à quelque chose à long terme, comme la mémoire?", A déclaré Waxham. "Je pense que l'une des contributions les plus intéressantes que nous apportons est de capturer comment le système prend les changements qui se produisent en quelques millisecondes à quelques secondes et construit quelque chose qui peut survivre au signal initial."
Le puzzle est loin d'être terminé, dit Wolyne. "Les travaux antérieurs de Margaret et Neal concernaient l'initiation d'événements de mémoire, " a-t-il dit à propos de l'étude de ses collègues sur la calmoduline. " Notre article sur les prions portait sur la préservation de la mémoire, à la fin du processus d'apprentissage. Et l'actine est au milieu. Il peut y avoir beaucoup d'autres choses au milieu, trop.
"Ces questions générales sont intéressantes pour beaucoup de gens, " a-t-il dit. " C'est un élément clé du problème, mais ce n'est clairement pas la fin de l'histoire."