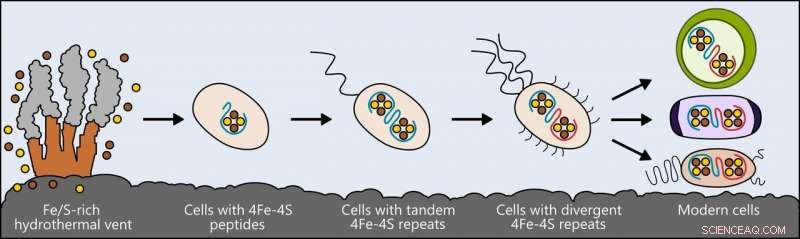
La vie peut avoir surgi à proximité de sources hydrothermales riches en fer et en soufre. Les premières cellules ont incorporé ces éléments dans de petits peptides, qui est devenue la première et la plus simple des ferredoxines - des protéines qui transportent les électrons dans la cellule, pour soutenir le métabolisme. Au fur et à mesure que les cellules évoluent, les ferredoxines ont muté en des formes plus complexes. Les ferredoxines dans les bactéries modernes, les cellules végétales et animales sont toutes dérivées de cet ancêtre simple. Crédit :Ian Campbell, Université du riz
Une étude dirigée par Rutgers met en lumière l'un des mystères les plus durables de la science :comment le métabolisme, le processus par lequel la vie s'alimente en convertissant l'énergie de la nourriture en mouvement et en croissance, a-t-il commencé ?
Pour répondre à cette question, les chercheurs ont procédé à une ingénierie inverse d'une protéine primordiale et l'ont insérée dans une bactérie vivante, où il a alimenté avec succès le métabolisme de la cellule, croissance et reproduction, selon l'étude de Actes de l'Académie nationale des sciences .
"Nous sommes plus près de comprendre le fonctionnement interne de l'ancienne cellule qui était l'ancêtre de toute vie sur terre - et, donc, pour comprendre comment la vie est apparue en premier lieu, et les chemins que la vie aurait pu emprunter sur d'autres mondes, " a déclaré l'auteur principal Andrew Mutter, un associé post-doctoral au Département des sciences marines et côtières de l'Université Rutgers.
La découverte a également des implications pour le domaine de la biologie synthétique, qui exploite le métabolisme des microbes pour produire des produits chimiques industriels; et bioélectronique, qui cherche à appliquer les circuits naturels des cellules pour le stockage d'énergie et d'autres fonctions.
Les chercheurs ont examiné une classe de protéines appelées ferredoxines, qui soutiennent le métabolisme des bactéries, les plantes et les animaux en déplaçant l'électricité à travers les cellules. Ces protéines ont différentes, formes complexes dans les êtres vivants d'aujourd'hui, mais les chercheurs pensent qu'ils sont tous issus d'une protéine beaucoup plus simple qui était présente dans l'ancêtre de toute vie.
Semblable à la façon dont les biologistes comparent les oiseaux et les reptiles modernes pour tirer des conclusions sur leur ancêtre commun, les chercheurs ont comparé les molécules de ferredoxine présentes dans les êtres vivants et, en utilisant des modèles informatiques, conçu des formes ancestrales qui peuvent avoir existé à un stade antérieur de l'évolution de la vie.
Cette recherche a conduit à la création d'une version de base de la protéine, une simple ferredoxine capable de conduire l'électricité à l'intérieur d'une cellule et qui, sur des éons d'évolution, aurait pu donner naissance aux nombreux types qui existent aujourd'hui.
Puis, prouver que leur modèle de l'ancienne protéine pouvait réellement soutenir la vie, ils l'ont inséré dans une cellule vivante. Ils ont pris le génome de la bactérie E. coli, supprimé le gène qu'il utilise pour créer la ferredoxine dans la nature, et épissés dans un gène pour leur protéine d'ingénierie inverse. La colonie d'E. coli modifiée a survécu et s'est développée bien que plus lentement que la normale.
Co-auteur de l'étude Vikas Nanda, professeur à la Rutgers Robert Wood Johnson Medical School and Center for Advanced Biotechnology and Medicine, a déclaré que les implications de la découverte pour la biologie synthétique et la bioélectronique proviennent du rôle des ferredoxines dans les circuits de la vie.
"Ces protéines canalisent l'électricité dans le cadre des circuits internes d'une cellule. Les ferredoxines qui apparaissent dans la vie moderne sont complexes, mais nous avons créé une version simplifiée qui soutient toujours la vie. De futures expériences pourraient s'appuyer sur cette version simple pour d'éventuelles applications industrielles , " dit Nanda.