
Instantanés d'une simulation révélant le mécanisme par lequel l'hélicase du virus de l'hépatite C brise les doubles brins d'ADN. Les deux domaines moteurs marchent le long du brin supérieur en utilisant le mécanisme de translocation du ver de terre. Le troisième domaine agit comme un coin séparant mécaniquement le duplex (de la figure 14). Crédit :Université de Kanazawa
La cellule vivante peut être considérée comme une usine où les machines à protéines sont en charge de divers processus, tels que le transport de matériel à l'intérieur de la cellule ou les opérations avec d'autres macromolécules comme l'ADN. Leur fonctionnement est généralement alimenté par des molécules d'ATP, le principal vecteur d'énergie dans les cellules biologiques. L'énergie chimique obtenue grâce à l'hydrolyse de l'ATP est utilisée par une machine à protéines pour changer cycliquement sa forme et ainsi remplir une fonction particulière. D'où, la résolution des changements de conformation fonctionnelle des protéines est un défi majeur, avec une importance fondamentale pour la compréhension et le contrôle des moteurs et des machines biologiques à molécule unique.
La complexité des interactions entre les atomes dans une machine à protéines est si élevée que même les meilleurs supercalculateurs du monde ne peuvent reproduire un seul de leurs cycles de fonctionnement. Dans cet article de synthèse, il est cependant démontré que des aspects essentiels du fonctionnement de tels nano-dispositifs naturels peuvent déjà être révélés en explorant des modèles mécaniques très simples de protéines, c'est-à-dire en traitant ces macromolécules comme des réseaux élastiques obtenus en connectant des particules avec un ensemble de ressorts élastiques.
Les auteurs, le professeur Alexander Mikhailov et le professeur assistant Holger Flechsig du Nano Life Science Institute de l'Université de Kanazawa au Japon, soutiennent que les réseaux élastiques correspondant aux machines à protéines à dynamique fonctionnelle ont des propriétés particulières, a émergé dans le processus d'évolution biologique. Malgré une apparente complexité, les mouvements internes dans de tels systèmes se déroulent de manière ordonnée, comme guidé le long de voies ferrées cachées. Ainsi, une machine moléculaire se comporte de manière similaire à des dispositifs mécaniques macroscopiques avec des mouvements hautement coordonnés de leurs pièces. Cela garantit que l'usine cellulaire peut fonctionner de manière robuste malgré les fortes fluctuations présentes à l'échelle nanométrique.
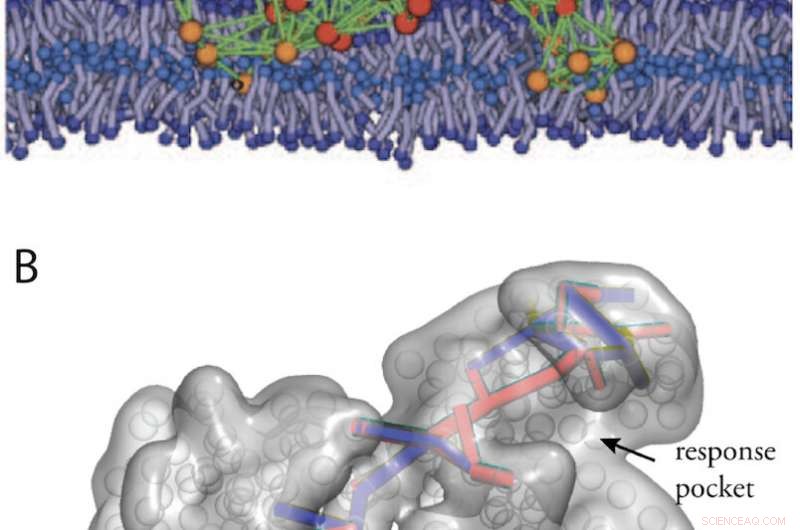
Structures artificielles ressemblant à des protéines obtenues par in-silico évolution. (A) Une machine à protéines modèle dans une membrane biologique (de la Fig. 11). (B) Voies de communication dans une structure allostérique conçue (à partir de la référence 34). Crédit :Université de Kanazawa
En utilisant cette approche, des simulations couvrant des cycles de fonctionnement entiers ont pu être réalisées et les premiers films moléculaires de machines à protéines ont ainsi été obtenus. Par exemple, La figure 1 de la publication originale de 2010 des auteurs montre comment la protéine motrice de l'hélicase du virus de l'hépatite C - une partie principale de sa machinerie de réplication et une cible pharmacologique importante pour les médicaments antiviraux - se déplace activement le long de l'ADN et le décompresse mécaniquement.
Des structures artificielles de type protéine avec des propriétés de machine pourraient en outre être conçues en exécutant une évolution informatique de réseaux élastiques. Dans la figure 2, deux exemples sont montrés, une machine modèle conçue fonctionnant à l'intérieur d'une membrane biologique, et une machine qui présente une communication allostérique.
Cet article de synthèse présente une nouvelle perspective dans la compréhension de la machinerie complexe des cellules biologiques. Il ouvre également la voie à de nouvelles approches dans la conception de nano-machines artificielles, une tâche à fort potentiel pour les futures applications biotechnologiques.