Crédit :Wiley
Les bactéries résistantes aux antibiotiques sont une menace croissante pour la santé, rendant les nouveaux antibiotiques indispensables. Des chercheurs allemands ont récemment fait une percée :ils ont découvert la lugdunine dans le nez humain, un nouveau type de peptide cyclique provenant de la bactérie Staphylococcus lugdunensis et possédant de fortes propriétés antimicrobiennes contre Stahphylococcus aureus, entre autres. Les chercheurs ont pu clarifier le mode d'action en synthétisant des variantes. Comme ils l'expliquent dans le journal Angewandte Chemie , le transport de protons à travers les membranes bactériennes est impliqué.
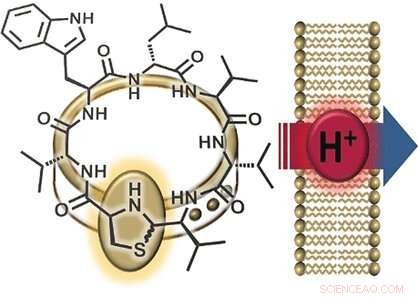
Une partie intéressante de la structure de la lugdunine est son groupe thiazolidine (un cycle composé d'un azote, un soufre, et trois atomes de carbone), qui fait partie de son cycle peptidique. Cet anneau à cinq chaînons ressemble à un fermoir qui « orne » l'anneau peptidique. Pour cette raison, les chercheurs ont nommé leur nouvelle classe de matériaux "fibupeptides, " du latin fibule , sens fermoir . Ayant précédemment réussi à synthétiser la lugdunine, l'équipe de l'Université de Tübingen et de l'Université de Göttingen (Allemagne) a optimisé la voie de synthèse pour fabriquer de nombreux dérivés différents de cette substance naturelle. Cela a permis une étude approfondie du mécanisme par lequel fonctionne la lugdunine. Les chercheurs ont fabriqué une série de dérivés dans lesquels ils ont remplacé chacun des acides aminés de l'anneau peptidique par de l'alanine - un dans lequel ils ont laissé le "fermoir ornemental, " et un fibupeptide dont la structure est l'image miroir de la lugdunine. Ils ont ensuite utilisé ces dérivés pour réaliser des tests d'activité.
L'équipe, composé de chimistes, biochimistes, et microbiologistes, découvert que la structure cyclique du peptide, le "fermoir thiazolidine", " et deux acides aminés (tryptophane et leucine), sont essentiels à l'activité antibiotique du composé. En outre, le cycle peptidique doit toujours être constitué d'une alternance d'acides aminés D et L. Cependant, il n'y avait aucune différence dans l'activité de la molécule d'origine ou de son image miroir. "Cela indique un manque d'interaction récepteur-ligand stéréospécifique, " déclare Nadine Schilling, membre de l'équipe dirigée par Stéphanie Grond, "au lieu, il parle d'interaction avec une petite molécule ou un ion."
Une autre observation était que les dérivés actifs de la lugdunine décomposent le potentiel électrique (la différence de tension entre l'intérieur et l'extérieur) des membranes cellulaires bactériennes, tuant ainsi les bactéries. L'incorporation d'une molécule supplémentaire de tryptophane a intensifié l'interaction avec la membrane et renforcé l'effet antibactérien. Dit Grond :"Ces résultats suggèrent un transport d'ions à travers la membrane bactérienne." Pour examiner de plus près cette caractéristique, les chercheurs ont produit des vésicules synthétiques avec un gradient de pH par rapport à la solution environnante. L'ajout de fibupeptides actifs a conduit à une égalisation rapide du pH, sans destruction de la membrane ni formation de pores. "Le mécanisme consiste clairement en une translocation de protons à travers la membrane, ", dit Grond. "Nous devons encore déterminer si la lugdunine agit comme un transporteur mobile ou un canal de protons."