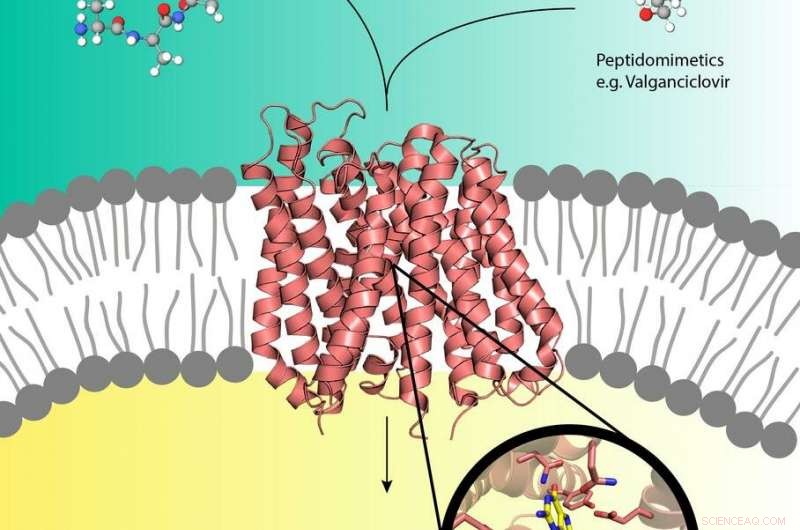
Les pro-médicaments comme le valganciclovir (en haut à droite) peuvent utiliser le transporteur de peptides (au centre) dans la membrane cellulaire qui transporte généralement les peptides nutritifs (en haut à gauche) dans la cellule. Crédit :LEBM, Yonca Oural-Blimke
Des expériences à la source de rayons X PETRA III de DESY ont révélé la première structure d'une protéine de transport biologique chargée d'un pro-médicament. Les promédicaments sont des médicaments inactifs qui sont métabolisés en un médicament actif, forme fonctionnelle dans le corps. Ils peuvent détourner les protéines de transport de nutriments humains PepT1 ou PepT2 qui sont situées dans la membrane cellulaire et canalisent généralement les peptides dérivés des aliments digérés dans les cellules. Par ici, les pro-drogues peuvent faire du stop directement dans la cellule, accélérer l'absorption du médicament. Alors que le concept pro-drogue est très efficace, on sait peu de choses au niveau moléculaire sur la structure des transporteurs de peptides et comment ils se reconnaissent, lier et transporter les pro-drogues. Les groupes de Christian Loew et Jan Kosinski du Laboratoire européen de biologie moléculaire (EMBL) travaillant au Centre de biologie des systèmes structurels (CSSB) sur le campus DESY à Hambourg font maintenant un pas de plus vers cette compréhension.
Les scientifiques ont déterminé la première structure cristalline à haute résolution d'un transporteur de peptides en complexe avec le promédicament valganciclovir pertinent sur le plan pharmacologique; un médicament qui combat certaines infections virales. leurs résultats, publié dans le Journal de l'American Chemical Society , pourrait aider à la conception de promédicaments avec des taux d'absorption améliorés. CSSB est une coopération de dix institutions scientifiques dont DESY.
Le transporteur peptidique bactérien DtpA d'Escherichia coli est un proche homologue du transporteur PepT1 humain et a donc été choisi par les scientifiques comme prototype. La structure spatiale d'une biomolécule peut être déterminée en faisant croître de minuscules cristaux à partir de plusieurs des mêmes biomolécules et en les illuminant avec des rayons X. Les cristaux diffractent les rayons X d'une manière qui est liée à leur structure interne. Ça signifie, du diagramme de diffraction, la structure interne du cristal peut être calculée, révélant la structure atomique de ses constituants, les biomolécules.
La croissance de cristaux de qualité suffisamment élevée à partir de biomolécules peut être très difficile. Pour produire des cristaux bien diffractants de DtpA, Loew s'est associé au groupe de Jan Steyaert de la Vrije Universiteit à Bruxelles pour générer des nanocorps spécifiques au DtpA. Les nanocorps sont des fragments d'anticorps spécifiques à domaine unique. "Ils augmentent la stabilité des protéines membranaires telles que le DtpA nous permettant ainsi de générer des cristaux de haute qualité, " explique Loew.
Le groupe Loew a ensuite réalisé les expériences de cristallisation du DtpA en complexe avec un nanocorps et une molécule pro-drogue à l'installation de préparation et de caractérisation d'échantillons (SPC) et a analysé les cristaux obtenus sur les lignes de lumière P13 et P14 qui font partie du X- de DESY. source lumineuse à rayons PETRA III et exploitée par t EMBL. Les scientifiques ont pu déterminer une structure de résolution de 2,65 Ångstrom (0,265 nanomètre) de DtpA liée au pro-médicament valganciclovir qui a révélé un mode de liaison inattendu. "L'orientation du pro-médicament dans la poche de reliure est inversée de 180 degrés par rapport aux prédictions précédentes, " explique Loew. " Nous avons également découvert que le DtpA se lie de préférence et transporte probablement les tripeptides sur les dipeptides. "
Le groupe Kosinski a construit un modèle structurel de haute qualité du transporteur PepT1 humain en complexe avec le valganciclovir en utilisant la structure cristalline DtpA comme guide. "Le modèle montre que le PepT1 humain se lie très probablement au médicament de la même manière que le DtpA et identifie les groupes d'acides aminés exacts responsables de la liaison, " précise Kosinski. Par conséquent, les informations générées par ce modèle de PepT1 peuvent faciliter le développement de nouveaux promédicaments avec des taux d'absorption améliorés. De telles améliorations non seulement réduiraient la dose pharmacologiquement efficace, mais pourraient également réduire les effets secondaires négatifs ressentis par les patients.