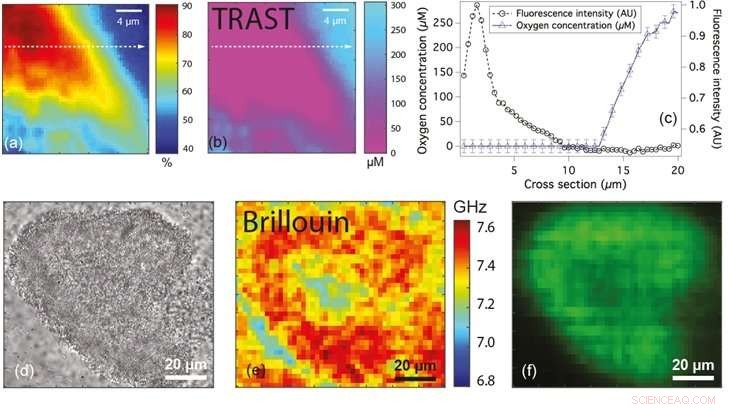
Les figures (a) et (b) montrent respectivement la carte de fluorescence et de concentration en oxygène d'une microcolonie de bactéries. La figure (c) montre le profil de la ligne de fluorescence (cercles) et de concentration en oxygène (triangles) le long de la ligne pointillée en (a) et (b). chiffres (d), (e) et (f) sont les microscopiques à grand champ, Images Brillouin et fluorescence respectivement d'une microcolonie bactérienne montrant des différences de décalage de fréquence, qui peut être utilisé pour classer l'état du biofilm. Crédit :Université nationale de Singapour
Scientifiques NUS, en collaboration avec des chercheurs de l'Université technologique de Nanyang (NTU) et de l'Imperial College London (ICL), ont développé des techniques biophysiques non invasives pour quantifier la concentration en oxygène et les propriétés micromécaniques des biofilms bactériens et comprendre leurs réponses en temps réel aux changements environnementaux.
Communautés de bactéries, champignons, les protozoaires ou les algues qui adhèrent les uns aux autres ou aux surfaces sont appelés biofilms. Les biofilms sont caractérisés par une variété de propriétés que l'on ne trouve généralement pas dans les organismes vivants isolés. L'une des propriétés émergentes des biofilms pertinentes dans le contexte de la santé humaine est leur tolérance accrue aux désinfectants et aux antibiotiques. Alors que certains biofilms sont bénéfiques (par exemple ceux impliqués dans le traitement des eaux usées et la bioremédiation), beaucoup d'autres sont nocifs (par exemple ceux impliqués dans les infections et la corrosion). Comme pour tout organisme vivant, les biofilms s'adaptent et répondent en permanence à une variété de stress environnementaux, tels que les changements dans la disponibilité des nutriments ou de l'oxygène.
L'oxygène joue un rôle essentiel dans la génération d'énergie pour l'entretien et la croissance des cellules. La quantification de la quantité d'oxygène est nécessaire pour étudier ses effets au cours des différentes étapes de la croissance du biofilm. Les outils actuels de mesure des niveaux d'oxygène dans les biofilms consomment eux-mêmes de l'oxygène (ce qui entraîne des résultats moins précis) ou ne peuvent obtenir des mesures précises qu'à partir de la surface mais pas à l'intérieur des biofilms.
Pour surmonter ces limites, Prof Thorsten WOHLAND des départements de sciences biologiques et de chimie, NUS, en collaboration avec le professeur Yehuda COHEN et le professeur Scott RICE de NTU, a adapté une technique non invasive appelée imagerie à état transitoire (TRAST) et l'a appliquée pour quantifier les niveaux d'oxygène dans les biofilms bactériens. Cela a conduit à l'identification de zones déficientes en oxygène au sein des colonies microscopiques de P. aeruginosa. TRAST est une technique d'imagerie basée sur la luminescence. Elle est basée sur le fait que certains fluorophores (un type de composé chimique fluorescent) occupent deux états différents, l'un émettant de la fluorescence et l'autre un état sombre non fluorescent. La fraction de fluorophores à l'état sombre dépend de la fréquence à laquelle les fluorophores sont excités et si on leur donne suffisamment de temps pour revenir des états sombres aux états fluorescents. En modifiant le schéma d'éclairage de manière définie, la quantité de fluorophores à travers le biofilm (à l'état sombre) peut être mesurée facilement. Les mesures ne dépendent que de la fraction de fluorophores à l'état sombre, ce qui signifie que la précision n'est pas affectée même si certaines régions du biofilm ont une concentration en fluorophore plus élevée. Puisque l'oxygène supprime l'occupation des états sombres, et abaisse ainsi les fluorophores qui résident à l'état sombre, TRAST peut être utilisé pour quantifier les concentrations d'oxygène.
Cet outil a des implications potentielles en microbiologie pour différencier les zones riches en oxygène des zones pauvres en oxygène, qui sont généralement occupés par des bactéries aérobies et anaérobies respectivement dans un biofilm multispécifique. Cette différenciation est importante dans le diagnostic car elle aidera à identifier le type de bactérie dans le site d'infection.
La même équipe de recherche en collaboration avec le professeur Peter TÖRÖK de l'ICL a également développé une technique utilisant la microscopie Brillouin pour sonder les propriétés mécaniques des biofilms à l'échelle micrométrique. La microscopie Brillouin permet de quantifier la compressibilité en mesurant le décalage de la fréquence de la lumière incidente lors de l'interaction avec le biofilm. La compressibilité d'un matériau est la quantité de contrainte nécessaire pour provoquer une modification du volume d'un matériau. La compressibilité d'un matériau peut être interprétée en termes de rigidité du matériau. Les matériaux qui présentent des décalages de fréquence plus importants sont plus rigides que ceux qui présentent des décalages de fréquence plus faibles. Cette technique, qui est « sans étiquette » (c'est-à-dire qu'il n'utilise aucune molécule étrangère), peut potentiellement être utilisé pour comprendre les propriétés micromécaniques des biofilms complexes.
Le professeur Wohland a dit, "Les biofilms peuvent avoir des effets destructeurs, par exemple dans l'infection des plaies ou dans la dégradation des matériaux. Cependant, ils peuvent également être exploités pour la production de matériel biologique ou d'autres procédés. Les deux applications nécessitent une bonne compréhension des propriétés physiques et physiologiques des biofilms. Par conséquent, de nouveaux outils, au fur et à mesure que notre équipe s'est développée, sont nécessaires pour mieux caractériser les biofilms dans leur environnement naturel."