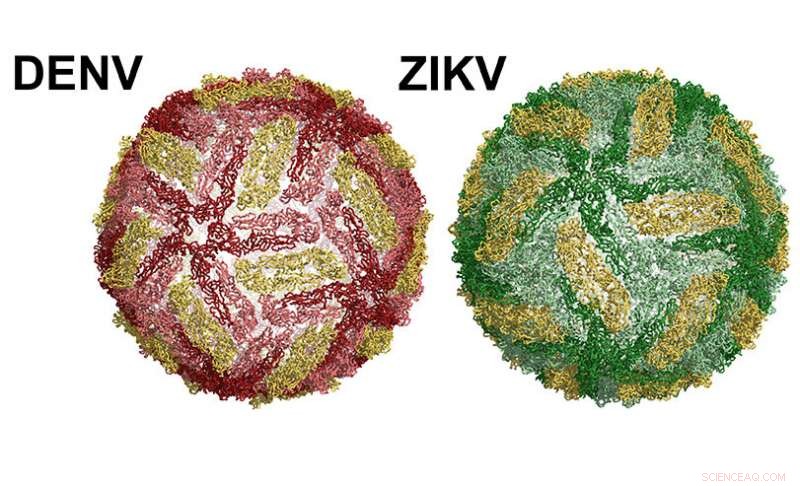
Une particule du virus de la Dengue à gauche. Zika à droite. Crédit:UNC School of Medicine
Une voie majeure vers la création de vaccins efficaces contre le virus de la dengue et le Zika implique la protéine E qui recouvre la surface de chaque particule virale. Si nous pouvions développer des anticorps puissants contre cette protéine E, alors ce serait le nœud d'un formidable vaccin, basé sur le fait important que les protéines 180 E viennent par paires. Mais la création d'un tel vaccin s'est avérée difficile pour un certain nombre de raisons. Les chercheurs de l'UNC School of Medicine ont maintenant défini les détails d'un obstacle majeur à un vaccin prometteur. C'est quelque chose que nous avons tous :une température corporelle naturelle d'environ 98,6 degrés.
Des études antérieures dans le laboratoire d'Aravinda de Silva ont montré que les humains créent des anticorps puissants contre la protéine E à la surface du virus, suggérant qu'une version soluble de la protéine E (appelée sRecE) pourrait faire un bon vaccin. Malheureusement, pour l'instant ça n'a pas marché, et les vaccins basés sur sRecE ont échoué. Chercheurs de l'UNC dirigés par Brian Kuhlman, Doctorat., professeur de biochimie et biophysique, et Aravinda de Silva, Doctorat., professeur de microbiologie et d'immunologie, ont montré que la température corporelle réduit la propension à l'appariement de sRecE et sa capacité à être reconnu par ces anticorps puissants.
Ces découvertes, publié dans le Journal de chimie biologique , suggèrent que la stabilisation de la propension à l'appariement de sRecE peut être essentielle à la création d'un vaccin efficace.
"Nous avons montré comment notre température corporelle naturelle subvertit la puissance sRecE et comment le développement futur de vaccins basés sur sRecE doit prendre en compte la température dès le début, " a déclaré Stephan Kudlacek, étudiant diplômé de l'UNC, le premier auteur sur le JBC papier.
Après des décennies de recherches intenses, Le développement de vaccins contre la dengue et le virus Zika a connu un succès limité. Ces flavivirus transmis par les moustiques sont un problème majeur de santé publique. Plus de 50 pour cent de la population mondiale est à risque d'infection, des centaines de millions de personnes sont infectées, et un grand pourcentage d'entre eux font face à de graves, symptômes débilitants. La dengue peut entraîner une maladie hémorragique potentiellement mortelle. Pendant ce temps, la récente épidémie de Zika a lié l'infection à Zika à de graves troubles neurologiques, comme la microcéphalie chez les nourrissons et le syndrome de Guillain-Barré chez les adultes. Pour ces raisons, le développement de vaccins a été accéléré pour protéger à la fois contre la dengue et le Zika.
Le développement d'un vaccin est difficile car il existe quatre sérotypes ou « saveurs » différents de la dengue, et un vaccin doit fournir une protection égale contre chacun d'eux. Aussi, un vaccin doit être créé de telle sorte qu'il ne stimule pas le système immunitaire à fabriquer des anticorps qui reconnaissent mais ne peuvent pas neutraliser le virus. Si cela arrive, la dengue et le Zika peuvent utiliser ces anticorps pour infecter les cellules du système immunitaire et aggraver l'infection - c'est ce qu'on appelle l'amélioration dépendante des anticorps.
Ce problème inhérent est la raison pour laquelle Dengvaxia, le seul vaccin homologué contre la dengue, n'est désormais recommandé que pour les personnes présentant une immunité partielle contre la dengue obtenue à la suite d'une infection antérieure à la dengue, car le vaccin semble augmenter le risque de maladie grave lorsqu'il est utilisé chez des personnes qui ont jamais été exposé au virus, et le vaccin assure une protection partielle entre les différents sérotypes de la dengue.
La surface des particules virales de la dengue et du virus Zika est structurellement similaire. Les deux virus sont recouverts d'une seule protéine, appelée protéine d'enveloppe (E). Chaque virus contient 180 copies de la protéine E à la surface, par paires de deux, appelés homodimères. Une version soluble de la protéine E, appelé sRecE, peuvent former la même structure homodimère observée par les protéines E à la surface du virus. Les patients infectés par la dengue et le Zika développent des anticorps neutralisants et protecteurs qui ciblent des régions spécifiques de la protéine E appelées épitopes. Cette connaissance a conduit les chercheurs à tester si la protéine E ou sRecE peuvent servir de vaccins efficaces. Malheureusement, Les vaccins à base de sRecE ont donné de mauvais résultats.
D'autres chercheurs ont découvert que bon nombre des anticorps neutralisants les plus puissants isolés de patients humains se lient aux épitopes présents sur l'homodimère de protéine E à la surface du virus, tandis que les anticorps faiblement neutralisants qui favorisent l'amélioration de la maladie se lient à un site sur le monomère de la protéine E - une seule copie de la protéine E, connue sous le nom de boucle de fusion. Une classe particulière d'anticorps puissants appelés anticorps E Dimer Epitope (EDE) reconnaît de manière frappante une région de la protéine E dans la dengue et le Zika. Ces anticorps sont capables de neutraliser les quatre sérotypes de la dengue et le Zika. Ces découvertes suggèrent que pour créer des vaccins efficaces, il sera important de concevoir des antigènes qui présentent ces épitopes dimères nouvellement découverts.
Les épitopes spécifiques aux dimères pourraient être le type le plus simple à créer, si vous utilisez des protéines recombinantes comme sRecE. Et il a été proposé que les homodimères sRecE puissent fonctionner comme des vaccins efficaces.
Mais des études ont suggéré que notre température corporelle naturelle de 98,6 degrés modifie la capacité de la protéine E à s'apparier et à former des homodimères à la surface du virus. Comme sRecE est un antigène prometteur pour le développement de vaccins, et puisque la stabilité de l'homodimère sRecE est importante pour présenter des épitopes d'anticorps dimères tels que l'EDE pour la vaccination, Les laboratoires de Kuhlman et de Silva ont cherché à comprendre comment la température affecte la stabilité de la protéine sRecE et sa capacité à former des homodimères.
"Nous avons utilisé un certain nombre de techniques biophysiques pour répondre à ces questions." dit Kudlacek. "Comme généralement observé, nous avons constaté que des températures plus froides aident à maintenir les protéines dans leur structure native ou active. À cause de ce, nous avons ensuite testé pour voir comment sRecE de trois sérotypes de dengue et dans Zika peut former des homodimères, comme on le voit à la surface du virus, dans un tampon à température ambiante."
Les chercheurs de l'UNC ont découvert que la dengue et le Zika sRecE forment des homodimères à température ambiante. "Mais quand nous avons fait l'expérience à température physiologique [98 ? F], tous les homodimères sRecE, y compris la dengue de sérotype 2 (DENV2) et Zika sRecE, se sont effondrés et sont devenus des monomères. Ce résultat a montré que les changements physiologiques de la protéine E induits par la température observés à la surface du virus se produisent également dans le sRecE. homodimères à température ambiante.
Les chercheurs se sont alors posé la question :puisque la dimérisation de sRecE est réduite à température physiologique, les anticorps qui reconnaissent spécifiquement le dimère E sont-ils capables de se lier à la dengue et à Zika sRecE à température physiologique ? Ils ont testé cela et ont constaté que les homodimères dengue et Zika sRecE se sont effondrés à 98,6F, éliminant ainsi les épitopes dimères présents dans l'homodimère sRecE et réduisant la liaison à l'anticorps.
« Nos résultats montrent que, à température corporelle, la présence d'homodimères dengue et Zika sRecE est fortement réduite, et la présence de monomère sRecE est augmentée, ", a déclaré Kudlacek. "Cela explique pourquoi les précédentes stratégies de vaccination basées sur le sRecE ont mal fonctionné, puisque la température corporelle favorise le monomère sRecE, concentrant ainsi le système immunitaire sur la génération d'anticorps plus faiblement neutralisants, ce qui peut entraîner une amélioration de la maladie, plutôt que de produire des anticorps spécifiques aux dimères neutralisants puissants."
Pour le développement futur d'un vaccin basé sur sRecE, ce travail suggère que l'homodimère sRecE doit être repensé pour être stable à la température corporelle afin que le système immunitaire puisse générer des anticorps spécifiques du dimère E suffisamment puissants pour protéger contre la maladie au lieu de l'améliorer.