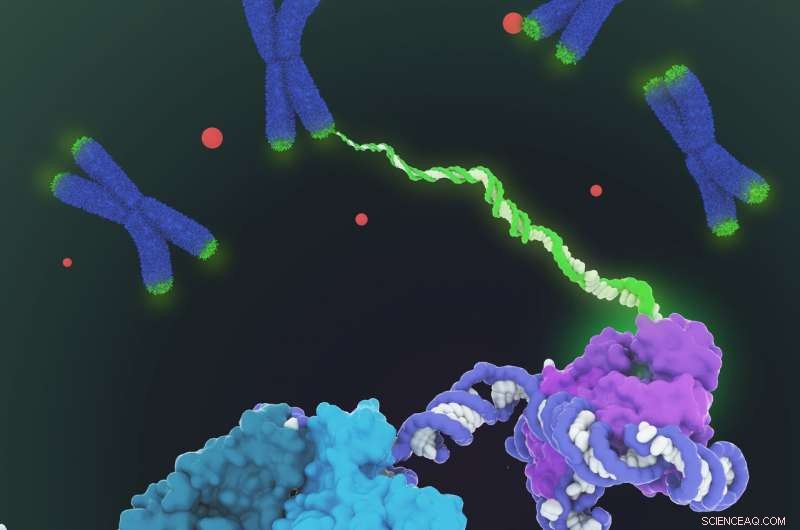
Il y a plus de 30 ans, lorsque l'Université de Californie, Des chercheurs de Berkeley ont découvert la télomérase - une enzyme qui allonge les extrémités des chromosomes et les empêche de s'effilocher suffisamment pour tuer une cellule - les spéculations se sont déchaînées sur son rôle dans le vieillissement et le cancer, déclencher une presse complète pour produire des médicaments pour activer ou bloquer l'enzyme.
Bien qu'aucun des médicaments anti-âge à base de télomérase, présenté comme une "fontaine de jouvence, " ni les médicaments anticancéreux ne sont encore apparus, la publication aujourd'hui par les scientifiques de l'UC Berkeley de la première image détaillée de la structure moléculaire de la télomérase humaine devrait relancer cet effort, permettant des criblages de médicaments plus ciblés et une conception intelligente de nouveaux médicaments.
"Cela a été long à venir. Il a fallu beaucoup de persévérance, " a déclaré Kathleen Collins, un professeur de biologie moléculaire et cellulaire de l'UC Berkeley qui a travaillé sur l'enzyme pendant 26 ans.
Collins et Eva Nogales, également professeur de biologie moléculaire et cellulaire, sont les auteurs principaux d'un article décrivant la structure moléculaire en 3D de l'enzyme télomérase humaine publiée cette semaine dans la revue La nature .
Un goulot d'étranglement a été l'obtention d'échantillons purs de cette molécule complexe, qui est composé d'un squelette d'ARN décoré par six types de protéines qui se déplacent en ajoutant de l'ADN aux extrémités des chromosomes. Les laboratoires du monde entier se sont demandé si l'enzyme fonctionne seule ou en tant que jumeaux siamois, et comment et combien de protéines décorent le squelette de l'ARN.