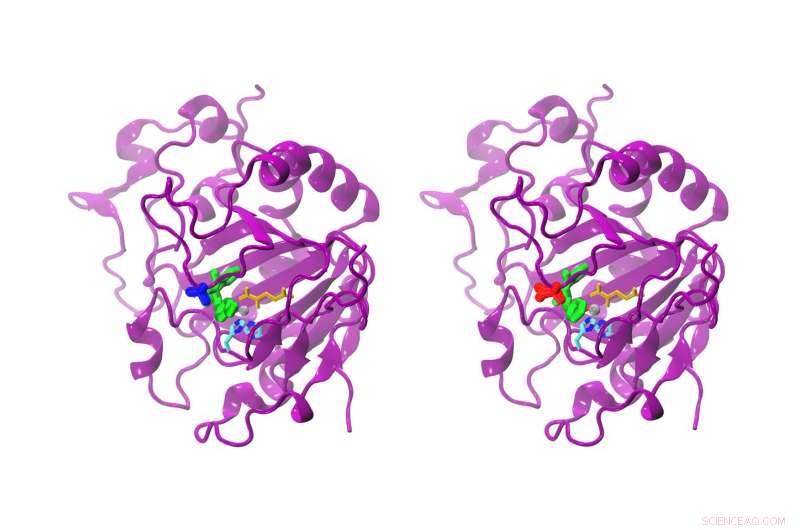
Alors que la différence entre l'AsqJ naturel et l'AsqJ modifié n'est qu'un acide aminé, la réactivité est clairement différente. L'AsqJ naturel (à gauche) possède une valine en position 72 (bleu). La forme modifiée possède une isoleucine (rouge) en position 72. Le substrat du site actif est de couleur verte, jaune d'alpha-cétoglutarate, l'atome de fer gris, et deux chaînes d'histidine cyan et bleu. Crédit :Sophie Mader/TUM
Pratiquement tous les processus biochimiques impliquent des enzymes qui accélèrent les réactions chimiques. Une équipe de recherche de l'Université technique de Munich (TUM) a pour la première fois déchiffré le mécanisme moléculaire de l'enzyme AsqJ. Leurs découvertes pourraient ouvrir de nouvelles options dans la production de molécules pharmaceutiquement actives.
Sans enzymes, la nature s'arrêterait. Ces minuscules molécules accélèrent les réactions biochimiques ou les rendent possibles en premier lieu. Mais comment cela se passe-t-il au niveau moléculaire ? « Comprendre la fonction exacte des enzymes est l'un des plus grands défis de la biochimie moderne, " dit Ville Kaila, Professeur de biocatalyse computationnelle à l'Université technique de Munich.
L'équipe de recherche dirigée par Ville Kaila et Michael Groll, Professeur de biochimie à l'Université technique de Munich, ont, pour la première fois, déchiffré le mécanisme de l'enzyme aspoquinolone J (AsqJ), une dioxygénase qui active les liaisons carbone avec l'oxygène.
L'enzyme AsqJ est particulièrement excitante car elle catalyse une cascade de réactions chimiques qui conduisent finalement à la formation de composés antibactériens. Il a été découvert il y a quelques années seulement dans le Aspergillus nidulans champignon. Les chercheurs ont combiné différentes méthodes pour découvrir les secrets contenus dans l'enzyme :Alois Bräuer et le professeur Michael Groll ont utilisé la cristallographie aux rayons X pour déterminer la structure atomique tridimensionnelle de la molécule. Sophie Mader et Ville Kaila ont ensuite utilisé ces informations pour réaliser des simulations de mécanique quantique sur ses processus biochimiques.
"Nos calculs illustrent comment l'enzyme catalyse la formation d'alcaloïde quinolone, " rapporte Kaila. " Les petits détails ont des effets étonnants :Un léger changement dans le substrat, comme l'élimination d'un petit groupe chimique, est suffisant pour pratiquement arrêter la réaction."
Prochain, l'équipe a conçu par ordinateur une nouvelle variante de l'enzyme qui catalyse la formation d'alcaloïdes quinolones avec le substrat modifié. Cette nouvelle enzyme a été produite expérimentalement dans des bactéries et testée pour sa fonctionnalité. « Les résultats ont été impressionnants :la réaction attendue a eu lieu au bout de quelques secondes seulement, " se souvient Bräuer.
"Cette expérience démontre que notre méthodologie fonctionne et est également adaptée pour représenter la fonctionnalité d'autres enzymes au niveau moléculaire, " dit Ville Kaila. La conception enzymatique est encore à un niveau basique, mais il a un potentiel énorme. À l'avenir, nous pourrions viser à concevoir par ordinateur des médicaments médicaux, par exemple.
"Le travail démontre que notre méthodologie est précise et également bien adaptée pour étudier la fonctionnalité d'autres enzymes au niveau moléculaire, " dit Ville Kaila. La conception d'enzymes est encore de la recherche fondamentale - mais elle a un potentiel énorme. L'un des objectifs de la recherche future sera de concevoir des enzymes dans un ordinateur pour, par exemple, produire de nouveaux médicaments.