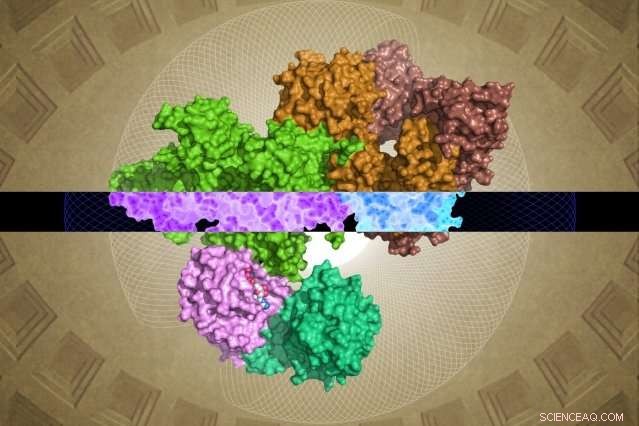
La structure GATOR1 générée par cryo-EM peut fournir des informations sur sa fonction. Crédit :Steven Lee/Institut Whitehead
Une équipe de chercheurs du Whitehead Institute et du Howard Hughes Medical Institute a révélé la structure d'un complexe protéique clé chez l'homme qui transmet des signaux sur les niveaux de nutriments, permettant aux cellules d'aligner leur croissance avec l'approvisionnement en matériaux nécessaires pour soutenir cette croissance. Ce complexe, appelé GATOR1, agit comme une sorte d'interrupteur marche-arrêt pour les signaux de « croissance » (ou de « ne pas croître ») qui circulent à travers une voie de croissance cellulaire critique connue sous le nom de mTORC1.
Malgré son importance, GATOR1 présente peu de similitude avec les protéines connues, laissant des lacunes majeures dans la compréhension des scientifiques de sa structure moléculaire et de sa fonction. Maintenant, tel que décrit en ligne le 28 mars dans le journal La nature , Les scientifiques de Whitehead et leurs collègues ont généré la première image moléculaire détaillée de GATOR1, révélant un groupe de protéines très ordonné et une interaction extrêmement inhabituelle avec son partenaire, le Rag GTPase.
"Si vous savez quelque chose sur la structure tridimensionnelle d'une protéine, alors vous pouvez faire des suppositions éclairées sur la façon dont cela pourrait fonctionner. Mais GATOR1 a été essentiellement une boîte noire, " dit l'auteur principal David Sabatini, membre du Whitehead Institute, professeur de biologie au MIT, et chercheur au Howard Hughes Medical Institute (HHMI). "Maintenant, pour la première fois, nous avons généré des images haute résolution de GATOR1 et pouvons commencer à disséquer le fonctionnement de ce complexe protéique critique."
GATOR1 a été identifié pour la première fois il y a environ cinq ans. Il se compose de trois sous-unités protéiques (Depdc5, Nprl2, et Nprl3), et des mutations dans ces sous-unités ont été associées à des maladies humaines, y compris les cancers et les affections neurologiques telles que l'épilepsie. Cependant, en raison du manque de similitude avec d'autres protéines, la majorité du complexe GATOR1 est un mystère moléculaire. "GATOR1 n'a pas de domaines protéiques bien définis, " explique le chercheur de Whitehead Kuang Shen, l'un des premiers auteurs de l'étude. "Donc, ce complexe est vraiment assez spécial et aussi très difficile à étudier."
En raison de la grande taille du complexe et de sa relative flexibilité, GATOR1 ne peut pas être facilement cristallisé - une étape nécessaire pour résoudre la structure des protéines grâce à la norme, Méthodes de cristallographie aux rayons X. Par conséquent, Shen et Sabatini se sont tournés vers Zhiheng Yu de HHMI. Yu et son équipe sont spécialisés en cryomicroscopie électronique (cryo-EM), une technique émergente qui est prometteuse pour visualiser les structures moléculaires de grandes protéines et complexes protéiques. Surtout, il n'utilise pas de cristaux de protéines. Au lieu, les protéines sont rapidement congelées dans une fine couche de glace vitrifiée puis imagées par un faisceau d'électrons rapides à l'intérieur d'une colonne de microscope électronique.
"Il y a eu des avancées majeures dans la technologie cryo-EM au cours de la dernière décennie, et maintenant, il est possible d'obtenir une résolution atomique ou proche de l'atome pour une variété de protéines, " explique Yu, un auteur principal de l'article et directeur de HHMI a partagé, installation cryo-EM ultramoderne du campus de recherche Janelia. Le prix Nobel de chimie de l'année dernière a été décerné à trois scientifiques pour leurs efforts pionniers dans le développement de la cryo-EM.
GATOR1 s'est avéré être un sujet délicat, même pour cryo-EM, et a nécessité quelques essais et erreurs de la part de Yu, Shen, et leurs collègues pour préparer des échantillons qui pourraient fournir des informations structurelles solides. De plus, le travail de l'équipe a été rendu encore plus difficile par la forme unique du complexe. Sans aucune idée de la structure potentielle de GATOR1, Shen et ses collègues, dont le co-auteur Edward Brignole du MIT, a dû le dériver complètement à partir de zéro.
Néanmoins, l'équipe Whitehead-HHMI a pu résoudre des structures quasi-complètes pour GATOR1 ainsi que pour GATOR1 lié à ses protéines partenaires, les Rag GTPases. (Deux régions de la sous-unité Depdc5 sont très flexibles et n'ont donc pas pu être résolues.) À partir de cette mine de nouvelles informations ainsi que des analyses biochimiques ultérieures de l'équipe, des découvertes surprenantes ont émergé.
Le premier est le remarquable niveau d'organisation de GATOR1. La protéine est extrêmement bien organisée, ce qui est assez inhabituel pour les protéines qui n'ont pas de structures prédites. (Ces protéines sont généralement assez désorganisées.) De plus, les chercheurs ont identifié quatre domaines protéiques qui n'avaient jamais été visualisés auparavant. Ces nouveaux motifs, nommés NTD, SABA, SHEN, et CTD - pourraient fournir des informations cruciales sur le fonctionnement interne du complexe GATOR1.
Shen, Sabatini, et leurs collègues ont découvert une autre surprise. Contrairement à d'autres protéines qui se lient aux Rag GTPases, GATOR1 contacte ces protéines à au moins deux sites distincts. De plus, l'un des sites de liaison sert à inhiber plutôt qu'à stimuler l'activité de la Rag GTPase. "Ce type de double liaison n'a jamais été observé - c'est très inhabituel, ", dit Shen. Les chercheurs émettent l'hypothèse que cette fonctionnalité est l'une des raisons pour lesquelles GATOR1 est si grand, car il doit contenir son Rag GTPase sur plusieurs sites, plutôt qu'un, comme le font la plupart des autres protéines de ce type.
Malgré ces surprises, les chercheurs reconnaissent que leurs analyses ont seulement commencé à effleurer la surface de GATOR1 et les mécanismes par lesquels il régule la voie de signalisation mTOR.
"Il reste beaucoup à découvrir dans cette protéine, " dit Sabatini.
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche du MIT, innovation et enseignement.