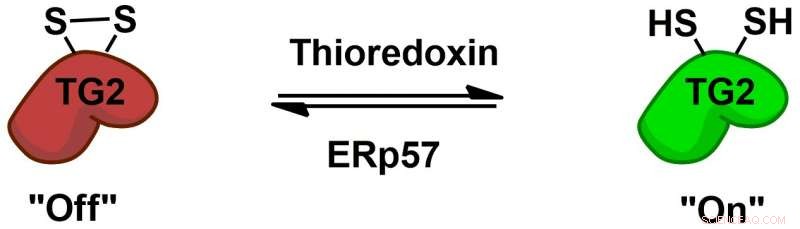
La transglutaminase 2 (TG2) est régulée de manière réversible par les cofacteurs protéiques thiorédoxine et ERp57 via un commutateur redox disulfure allostérique. Crédit :Chaitan Khosla, Université de Stanford
La maladie cœliaque est une maladie auto-immune qui affecte, selon certaines estimations, près de 1 personne sur 100. Les symptômes de la maladie cœliaque sont déclenchés par le gluten, une protéine présente dans le blé et les plantes apparentées, mais le gluten n'agit pas seul pour provoquer les symptômes digestifs dont souffrent les patients. Plutôt, le gluten induit une réponse immunitaire hyperactive lorsqu'il est modifié par l'enzyme transglutaminase 2, ou TG2, dans l'intestin grêle. Nouvelle recherche publiée dans le numéro du 23 février du Journal de chimie biologique identifie une enzyme qui désactive TG2, ouvrant potentiellement la voie à de nouveaux traitements pour la maladie cœliaque.
"Actuellement, les thérapies pour traiter les personnes atteintes de la maladie cœliaque font défaut. La meilleure approche en ce moment est juste une adhésion stricte à un régime sans gluten à vie, " a déclaré Michael Yi, un étudiant diplômé en génie chimique de l'Université de Stanford qui a dirigé la nouvelle étude. "Peut-être que la raison derrière cela est notre compréhension relativement faible de TG2."
La biochimie de la façon dont TG2 interagit avec le gluten et induit une réponse immunitaire a été bien étudiée, mais des mystères plus fondamentaux demeurent, par exemple comment se comporte TG2 chez les personnes sans maladie cœliaque. Chaitan Khosla, le professeur à Stanford et directeur de Stanford Chemistry, Engineering &Medicine for Human Health qui a supervisé la nouvelle étude, a mené plusieurs études montrant que TG2 peut être actif ou inactif, en fonction de la formation ou de la rupture d'une liaison chimique spécifique, appelé liaison disulfure, entre deux acides aminés dans l'enzyme.
"(E) même s'il y a beaucoup de protéine transglutaminase 2 dans (l'intestin grêle), tout est inactif, " a déclaré Khosla. " Quand il est devenu clair que même si la protéine était abondante, son activité était inexistante dans un organe sain, la question est devenue "Qu'est-ce qui active la protéine, et puis qu'est-ce qui désactive la protéine ? » En 2011, L'équipe de Khosla a identifié l'enzyme qui active TG2 en rompant sa liaison disulfure. Dans le nouveau journal, les chercheurs ont effectué des expériences sur des cultures cellulaires et ont trouvé une enzyme qui reforme cette liaison, inactivant TG2. Cette enzyme, ERp57, est principalement connu pour aider à replier les protéines à l'intérieur de la cellule. Quand il éteint TG2, il le fait en dehors des cellules, soulevant plus de questions sur ses fonctions chez les personnes en bonne santé.
"Personne ne comprend vraiment comment (Erp57) sort de la cellule, " dit Khosla. " La pensée générale est qu'il est exporté de la cellule en petites quantités; cette observation particulière suggère qu'il a en fait un rôle biologique à l'extérieur de la cellule."
TG2 est maintenant également la première protéine connue pour avoir un interrupteur marche/arrêt de liaison disulfure réversible de ce type. "Il s'agit d'un type de chimie intermittente très différent de celui que les chimistes médicinaux utiliseraient (généralement), ", a déclaré Khosla.
La compréhension de ce mécanisme a conduit l'équipe à rechercher s'il existe des médicaments approuvés par la FDA qui pourraient cibler directement le changement. Parce que des études antérieures ont suggéré que le manque de TG2 ne semble pas affecter négativement la santé des souris, bloquer TG2 est une voie prometteuse pour traiter les patients atteints de la maladie cœliaque sans nécessiter de modifications à vie de leur régime alimentaire.