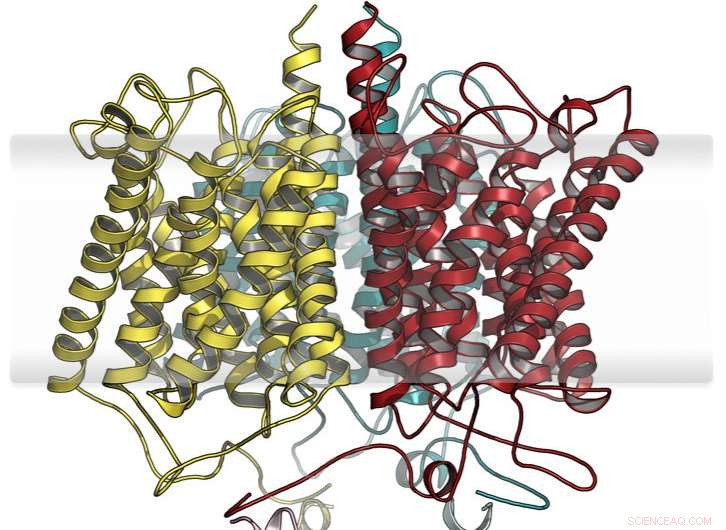
Modèle étendu hypothétique de la protéine capteur anammox ammonium. Crédit :Susana Andrade
Une équipe dirigée par la biochimiste fribourgeoise Prof. Dr. Susana Andrade a caractérisé une protéine qui permet à certains micro-organismes de reconnaître et d'absorber l'ammonium dans leur environnement. L'ammonium est considéré comme une toxine qui pollue les écosystèmes, mais pour ces bactéries, il représente une source importante de nutriments et d'énergie. Les chercheurs ont publié leurs découvertes dans la revue scientifique Communication Nature .
L'élément azote est un élément constitutif indispensable de toutes les biomolécules et donc d'une grande importance pour tous les organismes. En outre, certains membres de la communauté microbienne se sont spécialisés dans l'utilisation de divers composés azotés comme source d'énergie pour une croissance optimale. C'est particulièrement le cas parmi les oxydants d'ammonium anaérobies :ces bactéries n'ont pas besoin d'oxygène pour leur métabolisme mais, à la place, convertir deux importants composés azotés, ammonium et nitrite, en azote gazeux, qui représente environ 80 pour cent de l'atmosphère terrestre. Par cette réaction, ces micro-organismes jouent un rôle important dans la détoxification des composés azotés qui sont de plus en plus rejetés dans l'environnement par l'utilisation d'engrais.
Andrade et son équipe de la Faculté de chimie et de pharmacie de l'Université de Fribourg ont identifié une protéine inhabituelle dans de telles bactéries :la moitié ressemble à des protéines de transport connues pour les ions ammonium et l'autre moitié appartient à un groupe de protéines transductrices de signaux. Cela a conduit à soupçonner que deux blocs de construction, déjà existant dans la nature, avait été combiné de manière modulaire pour permettre une toute nouvelle fonctionnalité :la détection de l'ammonium dans l'environnement et la transmission ultérieure de cette information aux réseaux de signalisation cellulaire.
Les chercheurs ont entrepris une caractérisation fonctionnelle et structurelle complète de cette nouvelle protéine, qui impliquait également des groupes de travail du Centre médical universitaire de Fribourg; Université Radboud de Nimègue, Les Pays-Bas; l'Académie russe des sciences; et le Laboratoire européen de biologie moléculaire (EMBL) à Hambourg. Par conséquent, l'hypothèse initiale a été confirmée :sur la base d'une protéine de transport d'ammonium hautement sélective, l'évolution a donné naissance à un nouveau site de reconnaissance des ions, dont l'occupation entraîne des changements de conformation qui sont transmis au module de transduction de signal. Ce couplage modulaire direct offre la possibilité de fusionner d'autres unités de transduction de signal au module de capteur d'ammonium pour concevoir de nouvelles fonctionnalités cellulaires.