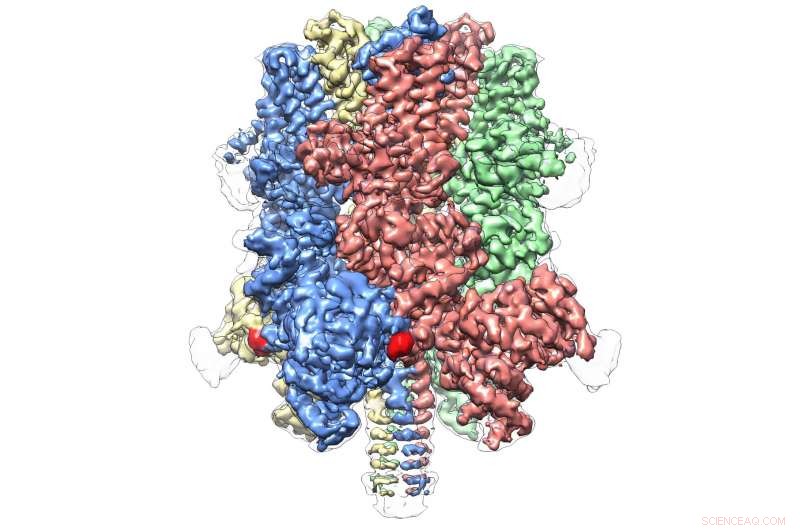
TRPM4 humain lié à l'agoniste Ca+ et au modulateur DVT à 3,8 Å. Crédit :Wei Lü, doctorat
Une équipe dirigée par des scientifiques du Van Andel Research Institute (VARI) a révélé pour la première fois la structure au niveau atomique d'une cible médicamenteuse prometteuse pour des affections telles que les accidents vasculaires cérébraux et les lésions cérébrales traumatiques.
Appelé TRPM4, cette protéine se trouve dans les tissus de tout le corps, y compris le cerveau, cœur, un rein, côlon et intestins, où il joue un rôle majeur dans la régulation du flux sanguin via la constriction des vaisseaux sanguins ainsi que dans l'établissement du rythme cardiaque et la modération des réponses immunitaires.
« Comprendre le rôle de TRPM4 dans la régulation de la circulation est vital, mais pendant des années, la recherche a été limitée par un manque de compréhension de son architecture moléculaire, " dit Wei Lu, Doctorat., professeur assistant à VARI et auteur principal d'une étude décrivant la structure de TRPM4, publié aujourd'hui dans La nature . "Nos résultats fournissent non seulement un carte au niveau atomique de cette protéine critique, mais aussi révéler des facettes complètement inattendues de son maquillage."
TRPM4 est impliqué de manière critique dans la régulation de l'apport sanguin au cerveau, qui ne représente qu'environ 2% du poids total du corps, mais reçoit 15 à 20% de son approvisionnement en sang. Conditions qui perturbent la circulation sanguine dans le cerveau, comme un accident vasculaire cérébral, lésion cérébrale traumatique, œdème cérébral et hypertension, peuvent avoir des conséquences dévastatrices et constituent d'importants problèmes de santé publique.
"De nombreuses garanties existent dans le système circulatoire du cerveau pour se protéger contre une interruption soudaine de l'approvisionnement en sang, dont l'un est TRPM4, " a déclaré Lü. "Nous espérons qu'une meilleure compréhension de ce à quoi ressemble cette protéine donnera aux scientifiques un modèle moléculaire sur lequel baser la conception de médicaments plus efficaces avec moins d'effets secondaires."
La structure de TRPM4 est nettement différente des autres molécules de la superfamille TRP, une catégorie de protéines qui médient les réponses aux sensations et aux stimuli sensoriels, comme la douleur, pression, vision, température et goût. Largement connus sous le nom de canaux ioniques, des protéines comme TRP se nichent dans les membranes des cellules, agissant comme gardiens des signaux chimiques entrant et sortant de la cellule.
Même au sein de sa propre sous-famille, qui comprend huit molécules au total, TRPM4 semble être totalement unique. La publication d'aujourd'hui représente la première vue atomique d'un membre de la sous-famille TRPM.
Il révèle une structure en forme de couronne, avec les quatre pics composant un grand domaine N-terminal, une caractéristique des protéines TRPM. Cette région, trouvé au début de la molécule, est un site majeur d'interaction avec l'environnement cellulaire et d'autres molécules de l'organisme. A l'opposé de TRPM4, communément appelé domaine C-terminal, L'équipe de Lü a trouvé une structure en forme de parapluie soutenue par un « poteau » et quatre « nervures » hélicoïdales, des caractéristiques qui n'avaient jamais été observées auparavant.
Les résultats ont été rendus possibles grâce à la suite de pointe de microscopie cryoélectronique de pointe David Van Andel de VARI, qui permet aux scientifiques de voir certains des plus petits composants de la vie dans des détails exquis. Le plus grand microscope de VARI, le Titan Krios, est l'un des moins de 120 dans le monde et est si puissant qu'il peut visualiser des molécules 1/10, 000e de la largeur d'un cheveu humain.
La structure de Lü est la deuxième structure moléculaire déterminée sur le Krios de l'Institut depuis l'achèvement de l'installation de la suite plus tôt cette année.