Crédit :CEA
Après 40 ans de recherche, chercheurs du CEA, CNRS, Université Grenoble-Alpes, L'université de Montpellier et l'Inserm ont enfin identifié l'enzyme responsable de la détyrosination de la tubuline. Étonnamment, ce n'est pas une enzyme mais deux qui contrôlent la modification de ce composant essentiel de la structure du cytosquelette. Ces travaux ouvrent de nouvelles perspectives pour une meilleure compréhension du rôle joué par la tubuline, dont la dérégulation a été liée aux cancers, maladies cardiovasculaires et troubles neuronaux.
Un projet international collaboratif impliquant des chercheurs du CEA (Commissariat à l'Energie Atomique), CNRS (Centre National de la Recherche Scientifique), Inserm (Institut National de la Santé et de la Recherche Médicale), Université Grenoble-Alpes, L'université de Montpellier et l'université de Stanford ont identifié l'enzyme, Tubuline CarboxyPeptidase (TCP), responsable de la transformation biochimique des microtubules cellulaires, par détyrosination. La détyrosination est une réaction biologique entraînant l'élimination de l'acide aminé terminal tyrosine de la -tubuline, l'une des sous-unités constituant les microtubules. Après quatre décennies de recherche, les biologistes ont enfin réussi à purifier cette protéine, et ont continué à fournir des preuves de son activité cellulaire.
Les microtubules contribuent aux fonctions cellulaires essentielles
Les microtubules sont des fibres dynamiques présentes dans toutes les cellules, ils sont formés par l'association de deux protéines (α-tubuline et β-tubuline). Les microtubules remplissent de nombreuses fonctions :ils séparent les chromosomes pour les répartir entre les deux cellules filles lors de la division cellulaire; ils contribuent à la polarité cellulaire, la morphologie et à la migration cellulaire; ils forment également un réseau à l'intérieur de la cellule, sur quels constituants cellulaires, tels que des protéines ou des brins d'ARN, peut être transporté.
Ces fonctions cellulaires sont régulées par des "signaux" présents à la surface des microtubules. Ces signaux, consistant en des modifications biochimiques des acides aminés (appelées modifications post-traductionnelles, tels qu'ils ont lieu après la synthèse des protéines), se produisent à de multiples sites dans les cellules et sont exécutés par une large gamme d'enzymes; dans ce cas, les enzymes modifient les tubulines.
L'enzyme TCP, enfin identifié après 40 ans de mystère
L'activité de l'une de ces enzymes a été identifiée pour la première fois en 1977 par une équipe de recherche argentine. Ils ont nommé cette activité "TCP" (Tubulin CarboxyPeptidase). Cette enzyme s'est avérée effectuer la réaction de détyrosination :élimination de l'acide aminé terminal, une tyrosine, de la fin de la α-tubuline, mais la protéine elle-même restait à identifier (sa taille et sa séquence étaient inconnues). Une autre enzyme, la ligase TTL, effectue la réaction inverse - la tyrosination - par laquelle la tyrosine est remplacée. Le cycle détyrosination/tyrosination est vital pour la cellule et l'organisme dans son ensemble. Une détyrosination massive (anormale) est observée dans un certain nombre de types de cancer sévères et dans les maladies cardiovasculaires.
L'identification et la caractérisation du TCP était donc un objectif majeur pour les chercheurs souhaitant comprendre la fonction physiologique de la détyrosination de la α-tubuline et déterminer les conséquences de son inhibition.
Pour isoler TCP, les chercheurs ont suivi son activité, utilisé des techniques biochimiques conventionnelles, et collaboré avec des chimistes de l'Université de Stanford, qui a développé une petite molécule inhibant son activité. Cette molécule a ensuite été utilisée comme appât pour « piéger » l'enzyme insaisissable.
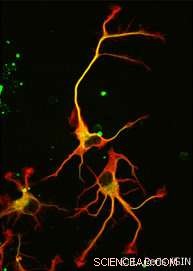
À la fin, pas une, mais deux enzymes ont été découvertes. VASH1 et VASH2 étaient déjà connus des scientifiques, mais ils n'avaient pas été auparavant associés au cytosquelette. Les chercheurs ont démontré que, lorsqu'il est associé à une protéine partenaire appelée SVBP, VASH1 et VASH2 peuvent provoquer une détyrosination de la -tubuline. Pour démontrer cette activité, l'équipe a inhibé l'expression de VASH1/2 (ou de leur partenaire SVBP) dans les neurones. Dans les deux cas, une très forte baisse du niveau de détyrosination de la -tubuline a été observée ainsi qu'une morphologie neuronale altérée (voir Figure). Les chercheurs ont ensuite démontré que ces enzymes sont également impliquées dans le développement du cortex cérébral.
Ainsi, 40 ans après la présentation des premières preuves de la détyrosination de la α-tubuline, les enzymes responsables ont été identifiées. Les scientifiques espèrent maintenant que, en modulant l'activité du TCP et en améliorant leur connaissance du cycle détyrosination/tyrosination, ils pourront développer de nouveaux traitements pour des cancers spécifiques, et mieux comprendre ses fonctions cérébrales et cardiaques.