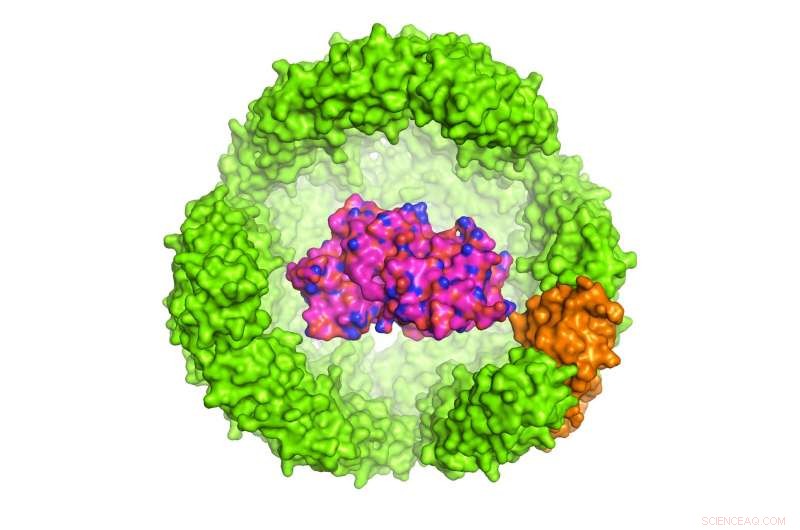
Illustration d'une protéine d'intérêt (POI) à l'intérieur d'un exoshell de ferritine de 24 sous-unités Archeoglobus fulgidus, qui fait 12 nanomètres de diamètre (seule la moitié de la coquille est représentée). Crédit :Dr Chester L. Drum
Une équipe de la NUS Yong Loo Lin School of Medicine (NUS Medicine) a inventé une façon fondamentalement nouvelle de replier et de protéger les protéines recombinantes. Issu du domaine en pleine expansion de la biologie synthétique, cette technologie protéine dans une protéine peut multiplier par 100 les rendements en protéines fonctionnelles et protéger les protéines recombinantes de la chaleur, produits chimiques agressifs et protéolyse.
L'expression et la stabilisation des protéines recombinantes est la pierre angulaire des industries biologiques et pharmaceutiques. Les coûts et la complexité associés à la fabrication de protéines recombinantes difficiles à replier à l'échelle industrielle sont un facteur limitant important à leur utilisation dans des applications cliniques et industrielles.
L'étude menée par le Dr Chester Drum, Professeur assistant aux départements de médecine et de biochimie, NUS Medicine a été publié dans la revue Communication Nature le 13 novembre 2017. Le Dr Drum et ses collègues ont conçu un exoshell de 12 nanomètres de diamètre et l'ont enroulé autour d'une protéine d'intérêt (POI). Ils ont montré pour la première fois que cette technologie peut être utilisée pour plier et protéger une variété de protéines dans des cavités conçues qui sont inférieures à 1:10, 000 la largeur d'un cheveu humain.
Les chercheurs ont développé cette technologie de protéine dans une protéine avec l'aide d'Archeoglobus fulgidus, une bactérie résistante que l'on trouve naturellement dans les cheminées hydrothermales. Ces bactéries hyperthermophiles ont développé des solutions uniques pour le repliement et la stabilisation des protéines en raison des environnements extrêmes dans lesquels elles vivent.
En particulier, les chercheurs ont utilisé un porte-fer, Protéine à 24 sous-unités dans A. fulgidus appelée ferritine, dont la fonction naturelle est de stocker et de transporter le fer dans le sang. La ferritine d'A. fulgidus a deux propriétés uniques :premièrement, quatre minuscules pores dans sa coquille permettent aux petites molécules d'accéder à la cavité; seconde, contrairement à la ferritine humaine qui est stable à de faibles concentrations en sel, la ferritine modifiée d'A. fulgidus se dissocie à de faibles concentrations en sel, permettant de libérer le contenu de la cavité par un simple changement de pH de 8,0 à 5,8. Une fois dissocié, le POI peut être libéré par voie enzymatique.
Pour démontrer la grande polyvalence de leur technologie, les chercheurs ont testé leur technologie exoshell en fusionnant l'une des 24 sous-unités de ferritine autour de trois POI aux propriétés diverses :protéine fluorescente verte, la peroxydase de raifort (HRP) et la luciférase de Renilla.
Non seulement l'exoshell a contribué à augmenter les rendements des trois POI, les chercheurs ont également pu délivrer des cofacteurs hème et calcium, en plus des conditions oxydantes, pour s'assurer que les POI complexes tels que la protéine HRP pourraient se replier et fonctionner correctement.
En plus d'aider à plier correctement les POI, les exoshells étaient également protecteurs contre un large éventail de dénaturants, y compris la trypsine à haute concentration; des solvants organiques tels que l'acétonitrile et le méthanol; et des dénaturants tels que l'urée, acide chlorhydrique guanidine, et de la chaleur.
"Nous émettons l'hypothèse que l'augmentation significative du rendement en protéines fonctionnelles peut être due à la complémentation entre les protéines chargées négativement et la surface interne de l'exoshell chargée positivement. Nos résultats mettent en évidence le potentiel d'utiliser des coquilles nanométriques hautement conçues comme outil de biologie synthétique pour considérablement affecter la production et la stabilité des protéines recombinantes, " a déclaré le Dr Drum, qui est également cardiologue consultant au National University Hospital et directeur du Clinical Trial Innovation Lab au TLGM, UNE ÉTOILE.
Recruté à l'Université nationale de Singapour en 2011, il a depuis reçu un financement de la Singapore MIT Alliance for Research and Technology, Conseil national de recherches médicales, Conseil de recherche biomédicale, A*STAR et NUS Médecine.
Les recherches actuelles du Dr Drum comblent le fossé entre la biochimie de base et les soins cliniques. Il est actuellement le chercheur principal d'un projet multi-institutionnel, 3, Essai d'observation de 000 personnes à Singapour qui étudie comment le métabolisme personnalisé des médicaments affecte la réponse aux médicaments.