Recherche récemment publiée dans Communication Nature examine les capacités d'une protéine humaine qui inhibe le VIH-1, APOBEC3G (A3G). L'article met en lumière les travaux du professeur et président de Northeastern Physics Mark Williams, chercheur postdoctoral Mike Morse, Professeur Linda Chelico, Université de la Saskatchewan au Canada, et Ioulia Rouzina, Université d'État de l'Ohio. Crédit :Mike Morse/Université Northeastern
Il y a quinze ans, une classe de protéines a été découverte, qui confèrent aux humains une immunité innée contre le VIH-1. Malheureusement, Le VIH-1 est un virus intelligent et a évolué pour combattre ces protéines. chercheurs du nord-est, avec l'aide de leurs collaborateurs, étudient ces protéines depuis plusieurs années pour mieux comprendre leur fonction et leurs mécanismes dans l'espoir d'être mieux préparés contre le VIH-1.
La recherche, Publié dans Communication Nature , met en lumière les travaux du professeur et président de Northeastern Physics Mark Williams, chercheur postdoctoral Mike Morse, Professeur Linda Chelico, Université de la Saskatchewan au Canada, et Ioulia Rouzina, Université d'État de l'Ohio. L'article examine les capacités d'une protéine humaine qui inhibe le VIH-1, APOBEC3G (A3G).
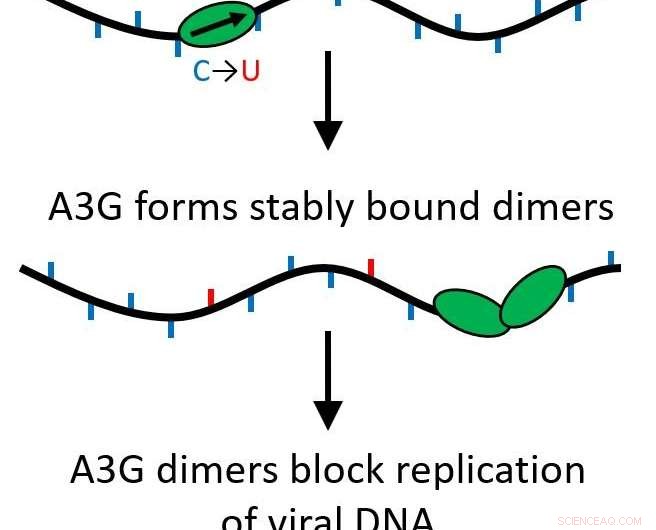
Leurs résultats ont déterminé que lorsque la protéine A3G passe d'une seule protéine (monomère) à un complexe à deux protéines (dimère), sa fonction est transformée d'être une protéine d'édition qui mute l'ADN viral en agissant comme un barrage routier pour une réplication ultérieure du virus.
"J'ai été complètement surpris par le résultat que les dimères étaient suffisants pour faire cela, " a déclaré Williams. "Nous avons obtenu nos données, et les données nous l'ont dit, mais il nous a fallu beaucoup de temps pour réaliser que la seule façon de comprendre ces données est que les dimères doivent être le modèle pour que les propriétés de la protéine changent soudainement."
Le Williams Laboratory for Single Molecule Biophysics est spécialisé dans les instruments appelés pinces optiques qui étudient des molécules telles que des molécules d'ADN simples ou des complexes ADN-protéine. Cet outil maintient l'ADN ou l'ARN entre deux billes de polystyrène pour examiner les interactions avec l'ADN en observant les changements de sa longueur et de sa tension. En utilisant cette technique, le laboratoire étudie de nombreux systèmes biologiques différents, y compris la réplication du VIH-1. Une combinaison de ces méthodes biophysiques avec les expériences d'activité enzymatique et la création de formes mutantes d'A3G par le laboratoire Chelico a permis à Williams et Morse de comparer la forme originale de la protéine avec différents mutants contenant des changements structurels. Cela a permis d'isoler le processus qui a abouti à une protéine dimérisée liée de manière stable.
Depuis 12 ans, le laboratoire Williams a étudié la réplication du VIH-1 avec l'aide d'une subvention du NIH. Leur projet le plus récent consiste à comprendre les protéines immunitaires innées qui confèrent aux humains une immunité contre le VIH-1. Il existe sept protéines dans la famille APOBEC3, dont certains combattent des rétrovirus comme le VIH-1, tandis que d'autres luttent contre les rétrotransposons, qui sont des éléments génétiques qui s'amplifient dans un génome et ont le potentiel de provoquer une maladie.
Toutes les protéines APOBEC sont des cytidine désaminases, leur permettant de modifier l'ADN simple brin pour remplacer les bases, provoquant des mutations lorsque le brin est répliqué. Cependant, A3G a également une autre fonction qui fait tout le contraire. Plutôt que de parcourir rapidement le génome en procédant à des modifications, il peut devenir une protéine de liaison stable qui inhibe le processus de transcription inverse, prévenir la réplication du VIH-1. Cela se produit à cause d'un processus appelé oligomérisation, où des unités protéiques simples (monomères) se rejoignent pour créer des complexes multiprotéiques ou des oligomères.
"L'idée que vous pourriez zoomer et faire ces changements, et pourtant empêcher quelque chose d'autre de bouger, n'avait pas vraiment de sens, " a déclaré Williams. "C'est pourquoi l'oligomérisation est si importante. Comme ils démarrent vite et avancent, avec le temps, ils s'oligomérisent et deviennent très lents."
Cette équipe de chercheurs a découvert l'oligomérisation telle que publiée dans leur article de 2014 dans Chimie de la nature . Leur étude a montré que la croissance d'un complexe multiprotéique provoquait un ralentissement de la protéine, mais on ne savait pas combien de protéines étaient nécessaires pour faire un complexe lent. Si le nombre était élevé, les résultats pourraient ne pas être pertinents pour la réplication virale. En outre, ils pouvaient montrer que les complexes étaient lents, mais ils ne pouvaient pas dire si les complexes lents avaient une activité enzymatique. Mais maintenant, leur nouvelle recherche a trouvé les réponses à ces deux questions cruciales.
"Entre nos expériences où nous avons observé directement la liaison des protéines sur l'ADN, et les travaux du professeur Chelico sur l'activité enzymatique de l'A3G, nous avons constaté que sur des échelles de temps courtes sous la forme monomérique, la protéine se lie et se dissocie très rapidement de l'ADN et possède une activité enzymatique élevée, " dit Morse. " Mais une fois que vous l'avez laissé former ces oligomères, la fixation est beaucoup plus stable, et ne se dissocie pas aussi facilement. Le professeur Chelico a pu découvrir que l'activité enzymatique diminue en fait lorsque ce processus se produit, vous avez donc ces deux fonctions - l'activité enzymatique qui se produit sur une échelle de temps, et sous une forme, et cette fonction secondaire qui, en raison de l'oligomérisation, se produit à une autre échelle de temps."
Leurs recherches ont montré que cela se produit même si seulement deux protéines se réunissent, formant un dimère. Le dimère est suffisant pour stabiliser le complexe protéique et modifier la fonction de la protéine. Comme seul un dimère est nécessaire, plusieurs barrages routiers pourraient agir pour empêcher la transcription inverse de se produire. Maintenant, cette fonction importante est plus susceptible d'être biologiquement pertinente.
"Savoir comment quelque chose inhibe le VIH-1 pourrait être un guide pour aider à concevoir de nouvelles méthodes pour les médicaments anti-VIH. Le virus VIH-1 a développé sa propre protéine pour tromper la cellule en dégradant les protéines APOBEC, donc si nous pouvons trouver un moyen d'arrêter cette dégradation, peut-être pourrions-nous améliorer la capacité de cette protéine à inhiber le VIH-1, ", a déclaré Williams.
Le Williams Lab de la Northeastern University prévoit de continuer à étudier les différentes protéines APOBEC, d'autres inhibent le VIH-1 ou les rétrotransposons. En étudiant ces protéines avec leurs outils de mesure biophysique uniques, leur laboratoire espère comprendre la régulation des protéines, activité, et des processus pour nous aider à mieux nous préparer contre le VIH et d'autres maladies connexes.