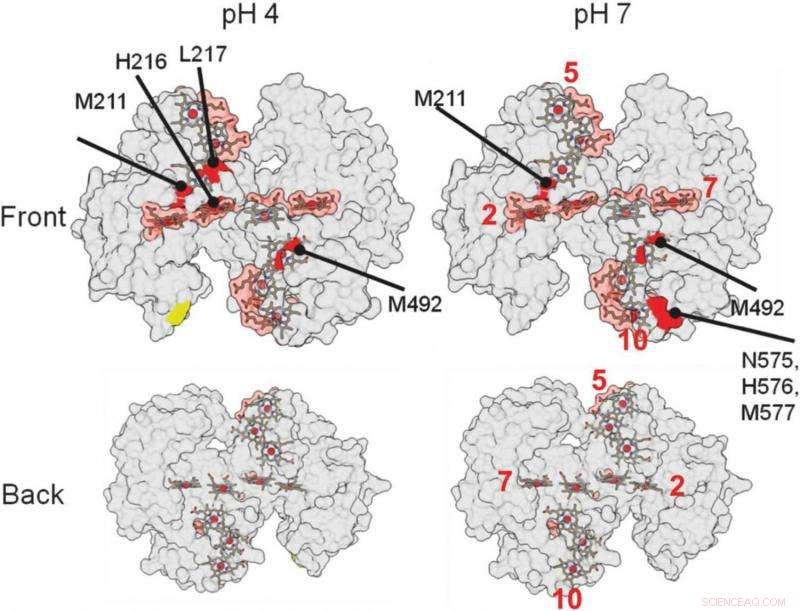
sur ces rendus structurels 3D de la protéine, aidé les chercheurs à identifier où la protéine se lie à un minéral. Les zones rouges indiquent les zones de liaison possibles. Crédit :Berkeley Lab
Les scientifiques ont découvert les détails d'un couplage non conventionnel entre une protéine bactérienne et un minéral qui permet à la bactérie de respirer lorsque l'oxygène n'est pas disponible.
La recherche, menée par une équipe de scientifiques du Lawrence Berkeley National Laboratory (Berkeley Lab) du ministère de l'Énergie, pourrait conduire à de nouvelles innovations dans la liaison des protéines à d'autres matériaux pour les dispositifs électroniques biosourcés, tels que des capteurs capables de diagnostiquer des maladies ou de détecter des contaminants. Cela pourrait également aider les chercheurs à comprendre et à contrôler les réactions chimiques déclenchées par ces interactions protéine-matériau.
« Déplacer des électrons vers des métaux peut provoquer la croissance ou la dissolution de différents minéraux. Étudier comment une protéine le fait peut nous aider à comprendre à la fois comment les organismes remodèlent leur environnement et fabriquent des biominéraux pour les dents ou la protection, " a déclaré Caroline Ajo-Franklin, membre du personnel scientifique de l'installation de nanostructures biologiques de la fonderie moléculaire de Berkeley Lab, qui est un centre de recherche en nanosciences.
Ajo-Franklin a dirigé l'étude, publié en ligne dans le Journal de l'American Chemical Society plus tôt ce mois-ci.
« Comprendre à quoi ressemblent ces interactions entre les protéines et les matériaux peut nous aider à mieux les concevoir, " elle a ajouté, "et nous donne un aperçu de la façon de connecter des cellules vivantes avec des appareils."
Les chercheurs se sont appuyés sur une technique basée sur les rayons X à la source lumineuse avancée (ALS) de Berkeley Lab, connu sous le nom d'« empreinte, " pour identifier les connexions chimiques entre la protéine bactérienne et les nanoparticules composées de fer et d'oxygène.
L'étude, qui a identifié un site de liaison étonnamment petit et faible, a également bénéficié des outils et de l'expertise de la Fonderie Moléculaire du Laboratoire; et le Joint BioEnergy Institute dirigé par un laboratoire, spécialisée dans la recherche sur les biocarburants.
La structure de cette protéine exotique avait déjà été cartographiée isolément avec des détails à l'échelle atomique par d'autres groupes de recherche utilisant la cristallographie aux rayons X, qui nécessitait une forme cristallisée de la protéine. Mais les scientifiques ne savaient pas comment il se liait au minéral contenant du métal - les techniques conventionnelles ne peuvent pas voir ce processus de liaison.

Sayan Gupta, un expert en empreinte aux rayons X, montre un type de porte-échantillon qui a été utilisé pour étudier comment une protéine se lie à un minéral. Crédit :Paul Mueller
En 2014, Ajo-Franklin a appris de Corie Ralston, un autre chercheur du Lab qui travaille dans la division Biophysique moléculaire et bioimagerie intégrée (MBIB), sur la technique d'empreinte par spectrométrie de masse à rayons X, une manière innovante de sonder avec précision les protéines et leur environnement avec des rayons X à l'ALS.
Ajo-Franklin et Ralston poursuivaient chacun des projets de recherche et développement dirigés par un laboratoire, et ils ont vu que les deux efforts pouvaient en fait être complémentaires.
Ralston avait adopté la technique d'empreinte aux rayons X de son ancien conseiller, Marc Chance, professeur à la Case Western Reserve University qui a établi la technique d'empreinte aux rayons X au Brookhaven National Laboratory à Long Island, N.Y. Cette technique aux rayons X n'est disponible qu'à l'ALS et à la Brookhaven's National Synchrotron Light Source II (NSLS-II).
"L'empreinte peut vous dire comment les protéines interagissent, " a déclaré Ralston. " Il peut fournir des informations structurelles et dynamiques sur les protéines à proximité de leur environnement natif. "
La protéine sélectionnée pour l'étude est issue d'une bactérie réductrice de métaux, Shewanella oneidensis, qui « mange du sucre et respire essentiellement des minéraux » lorsque l'oxygène n'est pas disponible, Ajo-Franklin a noté. "L'une des raisons pour lesquelles ces organismes sont si amusants à étudier est qu'ils interagissent avec un large éventail de matériaux."
Après Tatsuya Fukushima, un ancien scientifique du laboratoire qui était co-auteur principal de l'étude, trouvé un moyen approprié de préparer la protéine et les nanoparticules dans une solution liquide pour les études aux rayons X, Sayan Gupta, un expert en empreinte aux rayons X de la division MBIB de Berkeley Lab, utilisé une ligne de rayons X à l'ALS pour étudier les échantillons.
"Nous prenons des instantanés de l'état de cette molécule à un moment donné, " a déclaré Gupta. "C'est une technique simple et vous donne beaucoup d'informations sur l'état natif d'une protéine."
Dans cette technique, Les rayons X produisent des molécules hautement réactives appelées radicaux hydroxyles lorsqu'elles traversent la solution liquide entourant la protéine. Ces radicaux modifient la protéine d'une manière qui permet aux scientifiques d'identifier de légères variations chimiques là où la protéine est en contact avec la solution.
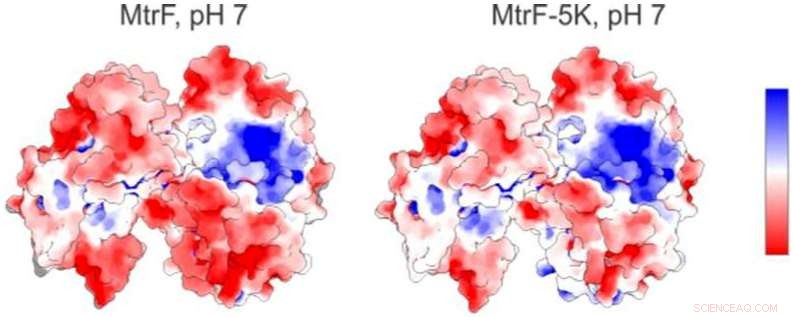
Une carte électrostatique (à gauche) d'une protéine étudiée à la source lumineuse avancée de Berkeley Lab montre des régions chargées positivement (bleu) et négativement (rouge). À droite se trouve une carte électrostatique prédite pour une forme mutante de la protéine. Crédit :Berkeley Lab
Les régions de la protéine qui interagissent avec d'autres protéines ou matériaux sont protégées des radicaux et non sujettes aux altérations chimiques. Les emplacements où la protéine n'est pas modifiée indiquent où se produit la liaison.
Dans la dernière étude, ces instantanés chimiques produits par la technique d'empreinte aux rayons X à différents moments ont ensuite été analysés à l'aide d'une technique connue sous le nom de spectrométrie de masse au Joint BioEnergy Institute.
Une analyse détaillée de Fukushima a révélé comment la protéine était liée au minéral.
"La plus grande découverte, c'était assez surprenant, était que nos protéines se lient relativement faiblement, " a déclaré Ajo-Franklin. " La plupart des protéines qui s'interfacent avec les matériaux se lient très étroitement, " changeant de forme au fur et à mesure qu'ils forment cette connexion. Cette protéine particulière ne semble pas du tout changer de forme et n'interagit avec le minéral que dans une petite zone, nécessitant environ cinq fois moins d'énergie de liaison, par comparaison, que les protéines typiques qui forment les biominéraux.
Cela a en fait beaucoup de sens, elle a ajouté. "Le travail de cette protéine est de transférer des électrons au minéral, il n'a donc pas besoin d'être en contact très longtemps."
L'équipe de recherche travaille maintenant à étudier comment cette protéine et des protéines similaires interagissent avec une gamme de minéraux.
"Il y a un tas de protéines dans cette famille, " Ajo-Franklin a déclaré. "Nous sommes vraiment ravis de voir comment ces protéines interagissent avec différents matériaux. Utilisent-ils tous la même stratégie de liaison ?"
Cette étude fournit déjà des idées sur la façon de reconcevoir ces protéines pour établir de meilleures connexions électroniques et donc des capteurs bioélectroniques plus sensibles – un projet sur lequel travaille Ajo-Franklin.