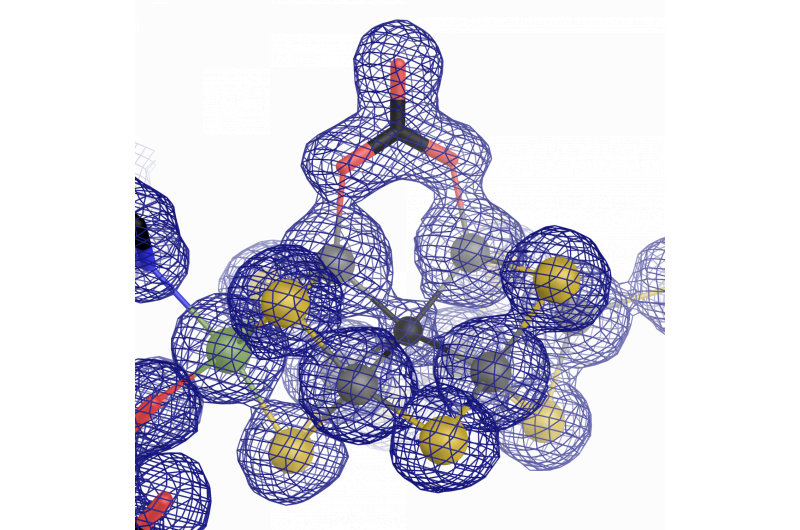
Le centre catalytique de la vanadium nitrogénase :un cofacteur fer-vanadium avec un ligand carbonate inhabituel. Crédit :Oliver Einsle
L'équipe de recherche du Prof. Dr. Oliver Einsle de l'Institut de biochimie de l'Université de Fribourg explore depuis longtemps le fonctionnement de la nitrogénase. Le groupe présente maintenant la première analyse structurelle tridimensionnelle de la variante enzymatique qui contient du vanadium. Dans le cadre de la préparation de sa thèse de doctorat, Daniel Sippel a réussi à produire et à cristalliser la vanadium nitrogénase. En prenant cela comme base, il a utilisé des expériences de diffraction des rayons X pour élucider sa structure spatiale au niveau de la résolution atomique. L'objectif à long terme de l'équipe est de rendre la nitrogénase biotechnologiquement utile afin de développer des alternatives aux procédés chimiques industriels. Les chercheurs ont présenté leurs résultats dans la revue scientifique Nature Chimie Biologie .
L'élément azote (N) est un composant clé de toutes les macromolécules organiques. Sa disponibilité dans la biosphère est limitée par le fait que l'occurrence globale de l'azote est confinée en grande partie au gaz N2 dans l'atmosphère. La stabilité du N2 le rend en outre inaccessible à presque tous les organismes. L'azote biologiquement disponible pour les engrais agricoles est fabriqué depuis 1906 en utilisant le procédé Haber-Bosch. Ce procédé industriel convertit l'azote atmosphérique (N2) en ammoniac par réaction avec l'hydrogène. Son importance est si importante aujourd'hui parce que la production alimentaire de plus de la moitié de la population mondiale ne peut être garantie qu'à l'aide d'engrais azotés. Dans la nature, une seule enzyme - la nitrogénase bactérienne - peut réaliser la même réaction, mais sans émettre de composés azotés en excès dans l'environnement, ou en d'autres termes, lessivage des nitrates dans les eaux souterraines. Pourtant jusqu'à maintenant, la fonction de ce complexe, système enzymatique contenant du métal qui contient du métal n'a été que partiellement expliqué.
L'équipe d'Einsle a déjà franchi une étape importante vers une meilleure compréhension de la nitrogénase. Les chercheurs ont pu inhiber l'activité de l'enzyme en utilisant le gaz toxique monoxyde de carbone (CO) pour montrer comment l'inhibiteur se lie au cofacteur fer-molybdène (FeMoco). Connu comme le noyau de la nitrogénase, il a été nommé pour les éléments qu'il contient. FeMoco peut catalyser la réaction de l'azote et de l'hydrogène dans une version naturelle du procédé Haber-Bosch. Dans le même temps, on savait qu'un variant de nitrogénase contenant du vanadium plutôt que du molybdène dans son centre actif et donc appelé FeVco peut également convertir le monoxyde de carbone. Les produits de cette réaction sont des composés carbonés réduits sous forme de courtes chaînes carbonées. Cette réaction est la version enzymatique d'un deuxième procédé chimique important - la synthèse Fischer-Tropsch d'hydrocarbures qui peut être utilisée à grande échelle pour synthétiser des carburants à partir de gaz résiduaires industriels, par exemple.
La vanadium nitrogénase présente dans les bactéries du sol peut, dans son environnement naturel, effectuer la même synthèse qui n'est possible que dans les procédés industriels à l'aide de pressions extrêmes et de températures élevées. Les procédés Haber-Bosch et Fischer-Tropsch sont utilisés chaque année pour convertir des centaines de millions de tonnes des gaz respectifs - N2 et CO - rendant la possibilité d'un développement durable, alternative biologique d'un intérêt scientifique considérable.
Au cours des travaux de recherche, il est devenu évident que la plupart des parties de l'architecture de l'enzyme étaient similaires à l'« original » contenant du molybdène. Néanmoins, il y a une distinction importante qui les distingue - la structure atomique du cofacteur catalytique. Sippel et Einsle ont découvert qu'un ion vanadium remplace l'ion molybdène dans FeVco, et comprend un remplacement supplémentaire d'un ion sulfure de pontage par un anion carbonate chimiquement très différent (μ-1, 3 carbonate-ligand pontant). Ce qui semble initialement être une légère différence a des effets de grande envergure sur la structure géométrique et électronique du cofacteur.
La recherche est financée par le Conseil européen de la recherche (ERC) et la Fondation allemande pour la recherche (DFG) dans le cadre du groupe de formation à la recherche 1976 "Diversité fonctionnelle des cofacteurs" de l'Université de Fribourg et du programme prioritaire "Fer-Soufre pour La vie."