
Pour la première fois, des scientifiques ont capturé la machinerie cellulaire qui fabrique une molécule vitale en train d'évoluer. Une enzyme clé que les plantes utilisent pour fabriquer la tyrosine, un acide aminé nécessaire à la vie, On pensait qu'il était conservé dans tout le règne végétal, mais les scientifiques ont découvert qu'il avait muté en une autre forme dans les légumineuses. Dans les tomates cerises, la forme canonique de l'enzyme domine, les arachides peuvent basculer et certaines souches de soja (haricots grumeleux à droite) ont perdu la forme canonique. Crédit :Jez Lab
Parce que les plantes ne peuvent pas se lever et s'enfuir, ils ont dû être intelligents à la place. Ce sont les chimistes du monde vivant, produisant des centaines de milliers de petites molécules qu'ils utilisent comme filtres solaires, empoisonner les mangeurs de plantes, parfumer l'air, colorer les fleurs, et pour bien d'autres affaires végétatives secrètes.
Historiquement, ces produits chimiques, appelés "métabolites secondaires, " ont été distingués des "métabolites primaires, " qui sont les éléments constitutifs des protéines, graisses, sucres et ADN. Les métabolites secondaires facilitent la vie mais les métabolites primaires sont essentiels, et le fait de ne pas les faire correctement et efficacement est fatal.
On pense que le métabolisme secondaire a évolué pour aider les ancêtres des plantes à vivre sur la terre ferme plutôt que sur les océans plus hospitaliers. L'idée est que les gènes des enzymes dans les chaînes d'assemblage moléculaires du métabolisme primaire ont été dupliqués. Les duplicatas étaient plus tolérants aux mutations qui auraient pu déstabiliser les voies primaires parce que les originaux étaient toujours en fonction. Avec des contraintes évolutives ainsi relâchées, la machinerie synthétique a pu accumuler suffisamment de mutations pour faire de la nouvelle chimie.
Métabolisme primaire, cependant, est largement conservé, ce qui signifie qu'il reste inchangé dans de nombreux groupes d'organismes différents, car il a été affiné pour fonctionner correctement et efficacement et parce que ses produits sont nécessaires à la vie. Ou alors disent les manuels.
Mais maintenant, une équipe collaborative de scientifiques a pris le métabolisme primaire en train d'évoluer. Dans une étude approfondie d'une chaîne d'assemblage de métabolisme primaire dans des plantes, ils ont découvert une enzyme clé évoluant à partir d'une forme canonique possédée par la plupart des plantes, par des formes non canoniques dans les tomates, à une forme d'interrupteur trouvée dans les arachides, et enfin s'engager dans la nouvelle forme dans certaines souches de soja.
Cet exploit, comparable à tirer la nappe de dessous la vaisselle sans en casser aucune, est décrit dans le numéro du 26 juin de Nature Chimie Biologie . C'est le travail d'une collaboration entre le laboratoire Maeda de l'Université du Wisconsin, qui s'intéresse depuis longtemps à cette voie biochimique, et le laboratoire Jez de l'Université Washington à St. Louis, qui a cristallisé l'enzyme du soja pour révéler comment la nature a changé le fonctionnement de la protéine.
"Le travail capture des plantes en train de construire une voie qui relie le métabolisme primaire au métabolisme secondaire, " dit Joseph Jez, le professeur Howard Hughes Medical Institute au département de biologie des arts et des sciences. "Nous voyons enfin comment l'évolution crée la machinerie pour fabriquer de nouvelles molécules."
Cela peut également avoir une importance pratique car les anciennes et les nouvelles voies fabriquent l'acide aminé tyrosine, qui est un précurseur de nombreux métabolites secondaires ayant une activité biologique et pharmaceutique, de la vitamine E aux opioïdes. Mais l'ancienne voie ne produit que de petites quantités de ces composés, en partie parce qu'ils doivent rivaliser pour les atomes de carbone avec le processus gourmand de fabrication de la lignine, les polymères résistants qui permettent aux plantes de se tenir debout.
La découverte de la nouvelle voie de fabrication de la tyrosine est beaucoup moins contrainte que l'ancienne. Cela soulève la possibilité que le flux de carbone pourrait être dirigé loin de la lignine, augmenter les rendements de médicaments ou de nutriments à des niveaux qui leur permettraient d'être produits en quantités commerciales.
Une histoire de deux enzymes
La tyrosine est fabriquée sur une chaîne de montage appelée voie shikimate, une voie métabolique en sept étapes que les plantes utilisent pour fabriquer les trois acides aminés qui ont des cycles aromatiques. Les animaux (y compris les humains) perdent la capacité d'ériger cette chaîne de montage au plus profond du passé évolutif. Parce que nous ne pouvons pas fabriquer nous-mêmes ces acides aminés et qu'ils sont essentiels à la vie, nous devons plutôt les obtenir en mangeant des plantes ou des champignons.
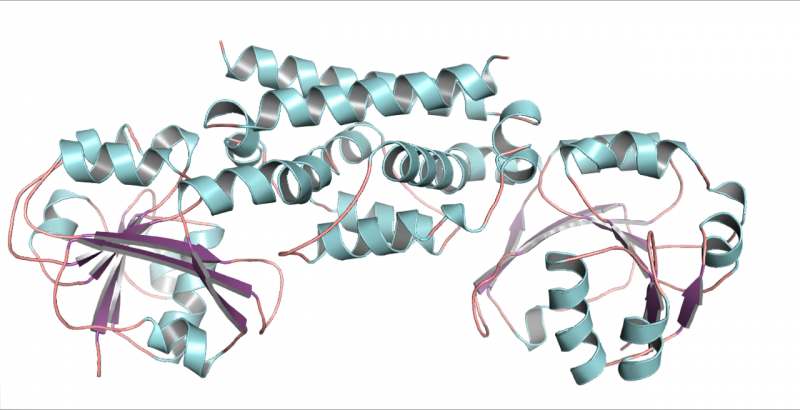
Une structure tridimensionnelle de l'enzyme PDH du soja, une légumineuse. Cette structure a permis de montrer qu'une seule mutation a permis aux légumineuses d'évoluer vers une nouvelle façon de fabriquer l'acide aminé tyrosine. Crédit :Craig Schenck
Cet anneau aromatique est important, dit Jez, parce que c'est une structure distinctive qui peut absorber la lumière ou l'énergie. Ainsi, les acides aminés aromatiques sont également les précurseurs de nombreux métabolites secondaires qui captent la lumière, transférer des électrons, ou des fleurs de couleur. De plus, les acides aminés aromatiques sont également des précurseurs de produits chimiques qui empoisonnent d'autres plantes ou prédateurs de plantes et attirent les pollinisateurs. De nombreux médicaments comprennent un anneau aromatique, commenta Jez.
Dans la plupart des plantes, la voie du shikimate se trouve dans le chloroplaste, l'organite qui fait le travail de conversion de l'énergie de la lumière du soleil en énergie stockée dans les liaisons carbone. Une fois fait, cependant, la tyrosine peut être exportée hors du cytosol pour incorporation ou conversion en d'autres composés.
Dans la dernière étape d'une branche de la voie, une enzyme appelée arogénate déshydrogénase (ADH), catalyse une réaction qui transforme le composé arogénate en tyrosine. L'enzyme ADH est considérée comme « régulatrice » car elle constitue un goulot d'étranglement dans la production de tyrosine. Il doit rivaliser pour le substrat arogénate avec la branche de la voie shikimate qui fabrique un acide aminé aromatique différent et il est fortement inhibé par l'accumulation de tyrosine
L'activité de l'ADH est courante chez les plantes, mais au cours de l'étude de la voie du shikimate, le laboratoire Maeda a découvert que les séquences d'ADN codant pour l'ADH dans certaines plantes à fleurs étaient significativement différentes de celles de la plupart des plantes. Ils ont appelé les enzymes produites par ces séquences ADH non canoniques. Puis, en 2014, ils ont signalé que certaines légumineuses fabriquent également de la tyrosine avec une enzyme différente, appelée préphénate déshydrogénase (PDH).
Le PDH diffère de l'ADH à bien des égards. Il est actif en dehors du chloroplaste, il agit sur le substrat préphénate plutôt que sur l'arogénate, parce qu'il est en dehors du chloroplaste, il n'a pas à rivaliser pour son substrat avec d'autres branches de la voie shikimate, et il n'est pas inhibé par l'augmentation des niveaux de tyrosine.
Pourquoi y a-t-il deux chaînes de montage différentes pour la tyrosine ? Les scientifiques pensent que l'enzyme PDH a évolué via deux événements de duplication de gènes et l'accumulation de mutations dans les copies "supplémentaires" du gène. Le premier événement a donné lieu à des ADH non standard dans certaines plantes à fleurs et le second à des PDH dans un sous-ensemble de légumineuses. Mais pourquoi est-ce arrivé?
Ce n'est pas une question à laquelle les scientifiques peuvent encore répondre, sauf en termes généraux, dit Jez. Ce qui ressort, cependant, est que la voie métabolique plus récemment évoluée n'est pas étroitement régulée et pourrait potentiellement produire des produits à un rythme effréné. Peut-être que les légumineuses avaient un besoin urgent de métabolites secondaires pour une raison quelconque. Il est certainement suspect que les légumineuses aient une écologie assez différente de celle des autres plantes, car ils vivent en symbiose avec les bactéries fixatrices d'azote.
Bricoler les bits
À ce stade, les scientifiques savaient que la nouvelle enzyme, PDH, lié à un substrat différent de l'enzyme d'origine, ADH. Ils savaient aussi que PDH, contrairement à l'ADH, n'a pas lié la tyrosine elle-même. Mais quels changements de structure ont conduit à ces différences d'activité chimique ?
Découvrir, Craig Schenck, un étudiant diplômé du laboratoire Maeda, comparé les séquences de gènes pour l'enzyme ADH ou PDH dans de nombreuses plantes différentes, soigneusement choisi pour être aux limites du passage d'une enzyme à l'autre. Mais ils ont rencontré un problème. Il y avait suffisamment de différences dans l'ADN qu'il était difficile de voir ce qui était pertinent, dit Jez.
Rencontrer Maeda lors d'une conférence, Jez a proposé d'essayer de cristalliser les nouvelles enzymes afin que leur structure puisse être reconstruite à partir d'images radiographiques. Son étudiante diplômée Cynthia Holland a pu cristalliser le PDH de soja et produire des images détaillées de sa forme tridimensionnelle.
"Une fois que vous avez regardé la structure, vous avez pu voir qu'il n'y avait que deux différences par rapport à l'ADH typique trouvé dans la plupart des plantes et qu'une seule des différences a réellement changé les choses, " A déclaré Jez. Étonnamment, cette différence était un seul acide aminé dans le site actif de l'enzyme. À cet endroit, l'asparagine avait remplacé l'acide aspartique.
Schenck a revérifié cette idée structurelle en retournant cet acide aminé dans les formes mutantes de l'enzyme. Le mutant ADH s'est avéré avoir une activité PDH, et le mutant PDH avait une activité ADH, tout comme l'équipe l'avait soupçonné.
"Cette différence modifie le substrat préféré de l'enzyme et sa capacité à être inhibée par la rétroaction de la tyrosine, " dit Jez. " Et si tu le regardes, c'est littéralement la différence entre un atome d'azote ou un atome d'oxygène. Dans ces protéines, qui sont constitués de près de trois cents acides aminés ou quarante-deux cents atomes, un atome fait toute la différence. C'est juste plutôt cool."
Le travail est important car il démontre que le métabolisme primaire évolue. Et parce qu'il montre comment la nature vole les machines du métabolisme primaire et les bricole pour fabriquer de nouveaux métabolites secondaires. Ils le font avec beaucoup plus de finesse que ce que les ingénieurs génétiques peuvent encore gérer.
"Quand on veut qu'une plante fabrique une nouvelle molécule, " Jez a dit, "nous insérons un gène et espérons qu'il s'intègre aux voies existantes. Nous ne savons toujours pas comment connecter facilement le câblage entre ce que nous introduisons et ce qui est déjà là. Il est donc intéressant de voir comment la nature s'est arrangée pour connecter le câblage et changer les choses sans les casser."