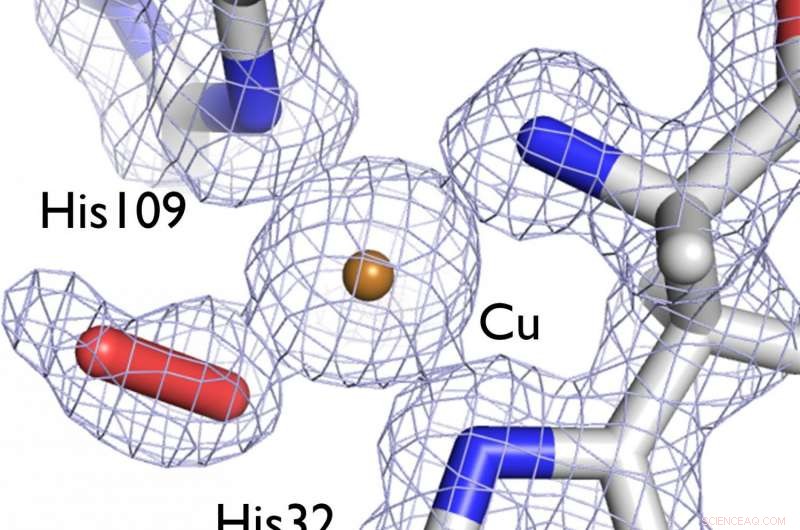
Comprendre la structure d'une enzyme qui aide les bactéries à décomposer la cellulose et la chitine dans les fibres végétales ligneuses peut aider à développer de meilleurs biocarburants. Dans cette image, une carte de densité électronique (en gris) montre la structure du centre du site actif de l'enzyme LPMO étudiée, représentant une molécule de dioxygène (bâton rouge) liée à un ion cuivre catalytique (bronze). Crédit :LANL
Par cristallographie neutronique, une équipe de recherche de Los Alamos a cartographié la structure tridimensionnelle d'une protéine qui décompose les polysaccharides, comme la cellulose fibreuse des graminées et des plantes ligneuses, une découverte qui pourrait aider à réduire le coût de création des biocarburants. La recherche s'est concentrée sur une classe d'enzymes dépendantes du cuivre appelées polysaccharides monooxygénases lytiques (LPMO), que les bactéries et les champignons utilisent pour décomposer naturellement la cellulose et les biopolymères de chitine étroitement liés.
"À long terme, comprendre le mécanisme de cette classe de protéines peut conduire à des enzymes aux caractéristiques améliorées qui rendent la production d'éthanol de plus en plus économiquement réalisable, " a déclaré Julian Chen, un scientifique du Laboratoire national de Los Alamos qui a participé à la recherche.
Une équipe multi-institutions a utilisé l'installation de diffusion de neutrons de la Spallation Neutron Source (SNS) du Oak Ridge National Laboratory et la source de rayons X synchrotron Advanced Light Source (ALS) du Lawrence Berkeley National Laboratory pour étudier le LPMO. SNS et ALS sont tous deux des installations pour les utilisateurs du DOE Office of Science.
Chen, scientifiques de la division des biosciences de Los Alamos, Clifford Unkefer, et ancien boursier postdoctoral John Bacik, travailler avec des collaborateurs du Laboratoire national d'Oak Ridge, Laboratoire Lawrence Berkeley, et l'Université norvégienne des sciences de la vie, résolu la structure d'un LPMO dégradant la chitine de la bactérie Jonesia denitrificans (JdLPMO10A). Les résultats de l'équipe sont publiés dans la revue Biochimie .
L'un des plus grands défis auxquels les scientifiques des biocarburants sont confrontés est de trouver des moyens rentables de décomposer les polysaccharides tels que les amidons et la cellulose, largement répandus dans les plantes, dans leurs sous-composants sucres pour la production de biocarburants. enzymes LPMO, qui sont considérés comme la clé de ce processus, utiliser un seul ion cuivre pour activer l'oxygène, une étape critique pour l'action de dégradation catalytique de l'enzyme.
Si le mécanisme spécifique d'action du LPMO reste incertain, on pense que la catalyse implique la formation initiale d'un superoxyde par transfert d'électrons à partir de l'ion cuivre réduit. En comprenant l'emplacement de l'ion cuivre et la constellation d'atomes à proximité, les chercheurs espèrent mieux comprendre la fonction de l'enzyme. Pour faire ça, ils reposent d'abord sur la détermination de la structure de l'enzyme.
Bien qu'un certain nombre de structures cristallographiques aux rayons X soient actuellement disponibles pour les LPMO d'espèces fongiques et bactériennes, cette nouvelle structure est plus complète. Les enquêteurs ont utilisé la cristallographie aux rayons X pour résoudre la structure tridimensionnelle en détail clair de tous les atomes à l'exception des hydrogènes, les atomes les plus petits et les plus abondants dans les protéines. Les positions des atomes d'hydrogène sont importantes pour élucider les caractéristiques fonctionnelles de la protéine cible et peuvent être mieux visualisées à l'aide d'une cristallographie neutronique. Les enquêteurs ont utilisé cette technique complémentaire, déterminer la structure tridimensionnelle du LPMO, mais en mettant en évidence les atomes d'hydrogène.
Notamment, dans cette étude, l'enzyme LPMO cristallisée a été capturée en train de lier l'oxygène. Avec les structures récentes des LPMO d'une grande variété d'espèces fongiques et bactériennes, les résultats de cette étude indiquent un mécanisme commun de dégradation de la biomasse cellulosique malgré de grandes différences dans leurs séquences protéiques. Cette étude a permis de mieux comprendre le mécanisme d'action des LPMO, notamment le rôle de l'ion cuivre et la nature de l'implication de l'oxygène.
La recherche sur les biocarburants fait partie de la mission du Laboratoire national de Los Alamos axée sur l'intégration de solutions de recherche et de développement pour obtenir un impact maximal sur les priorités stratégiques de sécurité nationale telles que les nouvelles sources d'énergie.