2 O sont difficiles, en grande partie à cause de la réactivité élevée du HF et de la tendance de l'eau à former des liaisons hydrogène.
Pour comprendre le mécanisme fondamental derrière la dissolution acide, Zhang et al. de l'Institut de recherche chimique de l'Université de Kyoto encapsulé HF, ainsi que HF•H 2 O et H 2 O dans un C 70 fullerène. Ils ont découvert que pour forcer les molécules dans la cavité ouverte du fullerène, les molécules nécessitaient une « poussée de l'extérieur » en utilisant des conditions de haute pression, et "tirer de l'intérieur" via des interactions moléculaires entre HF et H 2 O. Ils ont pu identifier comment la liaison hydrogène s'est produite entre ces deux molécules. Leur travail apparaît dans Avancées scientifiques .
Les travaux antérieurs de Zhang et al. a montré que le C 70 fullerène pourrait être ouvert dans un processus en trois étapes qui impliquait l'ajout d'un dérivé de pyridazine soit aux liaisons alpha ou bêta sur le C 70 . Cela a créé une ouverture de cycle à 13 membres qui a formé des composés légèrement différents, désigné par α-13mem et β-13mem. La déshydratation des deux composés a entraîné une ouverture de cycle de 16 membres. L'anneau pourrait être refermé par hydrolyse et un processus en deux étapes.
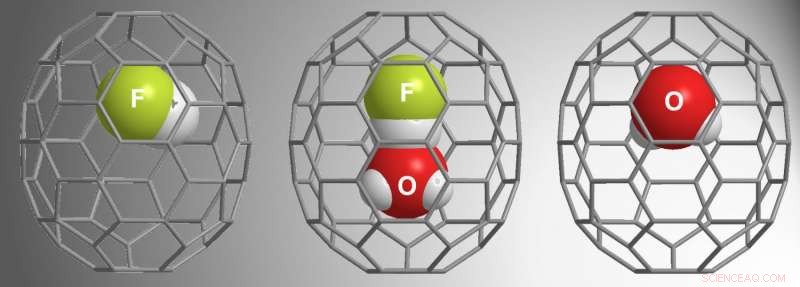
β-16mem était assez grand pour capturer H 2 , mais α-16mem ne l'était pas. Compte tenu de ces résultats d'études antérieures, pour l'étude en cours, Zhang et al. utilisé α-16mem pour essayer d'encapsuler HF. Au lieu, ils ont trouvé trois possibilités différentes dans les fullerènes :HF@C 70 , (HF•H 2 O)@C 70 , et H 2 O@C 70 .
Leurs conditions de réaction nécessitaient une pression élevée (9000 atm) pour "pousser" la molécule invitée dans la cavité -16mem. Des études en fonction du temps ont montré que l'HF remplissait la cavité en premier, suivi de H 2 O•HF, puis H 2 O. Notamment, la cage ouverte n'a pas piégé H 2 O quand HF n'était pas présent, indiquant que l'interaction entre H 2 O et HF incités H 2 encapsulation. D'autres études ont montré que HF "attire" H 2 O dans la cavité tandis que l'environnement à haute pression "le pousse" dans la cavité.
Ce processus a permis aux auteurs d'étudier l'interaction entre H 2 O et HF dans un environnement confiné en utilisant
1
RMN H. L'analyse RMN a montré que le (H 2 O•HF)@C 70 a été rétrogradé de H 2 O@C 70 et HF@C 70 , qui indiquait une liaison hydrogène. Par ailleurs, les valeurs de décalage et de couplage indiquaient que l'oxygène agissait comme accepteur de liaison hydrogène.
En utilisant la diffraction des rayons X sur monocristal, Zhang et al. a démontré la structure du (HF•H 2 O)@C 70 , et rapportent la première structure aux rayons X pour le C doublement encapsulé 70 . Ces analyses et études expérimentales ont confirmé que le H
+
ion dans HF forme une liaison hydrogène linéaire avec le O dans H 2 O. De plus, par rapport aux calculs théoriques de H libre 2 O et HF, les études des molécules encapsulées ont révélé un contact étroit avec l'hydrogène et l'oxygène qui peut être caractéristique de H3O
+
•F
-
.
Le C 70 le dérivé de fullerène fournit un excellent nanoenvironnement pour l'étude d'espèces chimiques isolées, quelque chose qui n'était pas disponible pour les chimistes dans le passé. Cet environnement isolé a permis aux auteurs d'étudier les interactions de deux composés sans interférence de l'environnement environnant et a fourni des informations importantes sur un processus chimique omniprésent.
© 2017 Phys.org