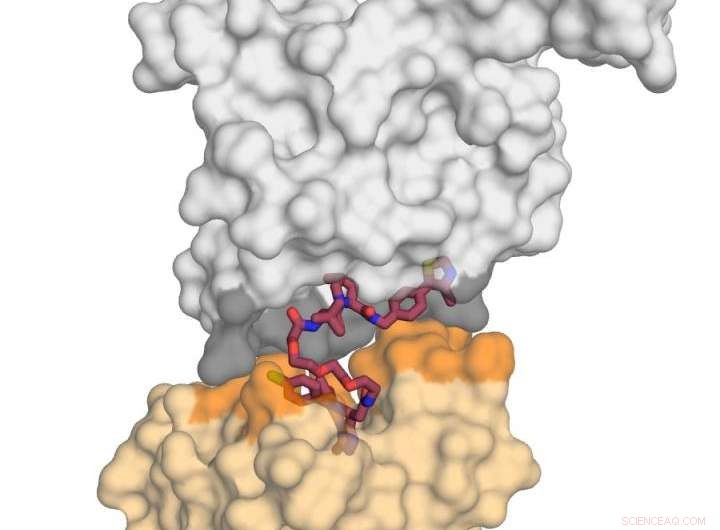
L'image montre la protéine ligase E3 VHL (en gris) en complexe avec la petite molécule MZ1 (en framboise) et 'embrassant' la protéine BRD4 (en jaune). Après avoir reçu ce "baiser" mortel, BRD4 est ciblé pour la dégradation. Crédit :Xavier Lucas, Alessio Ciulli, Université de Dundee
Des scientifiques de l'Université de Dundee ont signalé une percée majeure dans le ciblage des causes de nombreuses maladies, utilisant un "baiser de la mort" pour détruire des protéines qui étaient auparavant considérées comme "non médicamenteuses".
On en sait beaucoup sur les protéines telles que Ras et Myc qui sont connues pour être coupables du cancer humain, et Huntingtine, qui cause la maladie de Huntingdon, mais jusqu'à présent, ils se sont montrés obstinément résistants aux efforts visant à trouver des moyens de les combattre avec des médicaments.
Aujourd'hui, des chercheurs dirigés par le professeur Alessio Ciulli de la School of Life Sciences de Dundee ont trouvé un moyen de cibler des protéines similaires, utiliser une approche de petites molécules de manière non conventionnelle pour cibler les «mauvaises» protéines en les liant à des agents neutralisants pour lancer un processus de dégradation, et ainsi les supprimer entièrement.
"Nous connaissons de nombreuses protéines qui sont actives dans l'apparition de maladies, mais que nous n'avons pas pu empêcher de devenir « voyous » ou de les arrêter quand ils le font, " a déclaré le professeur Ciulli.
"Le problème majeur est que nous n'avons pas pu trouver les petites molécules qui peuvent se lier avec succès à ces protéines et en même temps entraver leur fonction. C'est un domaine très complexe - ces protéines peuvent souvent tromper les régulateurs au sein de la cellule et être extrêmement difficile à cerner avec des inhibiteurs.
« La recherche dans notre laboratoire au cours des dernières années a contribué à établir une approche différente, un qui a été théorisé pendant de nombreuses années mais qui n'est pleinement réalisé que maintenant par ce dernier travail. Au lieu d'utiliser la petite molécule pour essayer de désactiver la mauvaise protéine, nous avons développé un moyen de le modifier pour qu'il puisse être utilisé pour attirer les protéines neutralisantes, qui se lient alors à leur mauvais voisin et agissent contre lui, démarrage d'un processus de dégradation en cascade.
« Surtout, nous avons également constaté qu'il ne suffit pas que cette protéine neutralisante se trouve près de la mauvaise protéine, il doit entrer en contact direct avec elle, pour "l'embrasser". Et pas seulement un petit bisou, mais une véritable étreinte "Autant en emporte le vent". Nous appelons cela un "baiser de la mort", car c'est la clé pour assurer la dégradation de la mauvaise protéine."
Le professeur Ciulli et ses collègues ont concentré leur attention sur une molécule de dégradation chimique bivalente appelée "PROTAC" (molécules chimériques ciblant la protéolyse). Ils ont pu créer la première structure cristalline aux rayons X d'un PROTAC lié à la fois à la «mauvaise» protéine et à l'agent «neutralisant» (une ubiquitine ligase E3), et a découvert qu'il peut être déployé avec succès comme un « aimant » pour attirer les deux protéines cibles ensemble.
"Cette découverte fournit les toutes premières informations sur le fonctionnement des PROTAC et sur la manière dont nous pouvons cibler les protéines pour la dégradation de manière hautement sélective, " a déclaré le professeur Ciulli.
"Cela présente un changement de paradigme dans la façon dont nous pouvons assurer une intervention chimique sélective contre des protéines dont nous savons qu'elles sont des facteurs de maladie, mais qu'il était jusqu'à présent impossible de cibler avec succès. Cela indique la possibilité de droguer l'"undrugable"."
Les résultats de la recherche sont publiés dans la revue Nature Chimie Biologie .
Les travaux de l'équipe de Dundee ont porté sur l'appariement de l'une des protéines bromodomaines BET, BRD4, qui est une cible thérapeutique attractive pour le cancer, avec un "dégradateur" sélectif BRD4 appelé MZ1. Ils ont découvert que MZ1 pouvait rassembler les deux protéines en se repliant sur elle-même. Une fois que les deux protéines sont jointes dans leur « baiser », les interactions entre elles conduisent à la dégradation de la cible. Ils ont montré comment les protéines similaires BRD2 et BRD3 n'embrassent pas aussi la protéine neutralisante, et guidés par ces informations, ils ont pu concevoir de nouveaux dégradeurs qui épargnent complètement ces protéines du processus de dégradation. Ceci est important car il élucide comment les molécules dégradantes pourraient être conçues à l'avenir pour minimiser les effets hors cible d'une manière qui pourrait ne pas être possible avec des inhibiteurs conventionnels.
L'équipe de Dundee travaillant sur le projet comprenait des chercheurs postdoctoraux du laboratoire du professeur Ciulli, Morgan Gadd, Andrea Testa, Xavier Lucas et Kwok-Ho Chan, et Wengzhan Chan et Dougie Lamont du Dundee Fingerprints Proteomics Facility.
Le professeur Ciulli a déclaré qu'il y avait déjà des signes prometteurs de la part de l'industrie pharmaceutique d'investissements importants dans ce domaine de recherche.
« Nous comprenons maintenant mieux comment transformer les inhibiteurs en dégradants. La route pour transformer les dégradants en médicaments sera longue et sinueuse et nous ne pouvons pas y arriver par nous-mêmes. C'est excitant de voir des signes d'engagement sérieux de la part de l'industrie pharmaceutique, ce qui ajoute à l'optimisme que nous pourrons arriver à un point où nous pourrons droguer l'"undrugable".