Un groupe de chercheurs a élargi les connaissances conventionnelles sur une enzyme essentielle qui contrôle la migration cellulaire. Dans une publication dans la revue Nature Communications , ils ont rapporté que la phosphoinositide 3-kinase (PI3K) agit non seulement comme un accélérateur pour stimuler la motilité cellulaire, mais qu'elle possède également un mécanisme de freinage intégré qui empêche la migration.
"PI3K est une enzyme de signalisation majeure qui a été largement étudiée depuis plus de 30 ans en raison de son rôle dans les fonctions cellulaires fondamentales telles que la croissance, la survie, le mouvement et le métabolisme", explique Hideaki Matsubayashi, auteur principal de l'étude et professeur adjoint à Frontier de l'Université de Tohoku. Institut de recherche en sciences interdisciplinaires (FRIS).
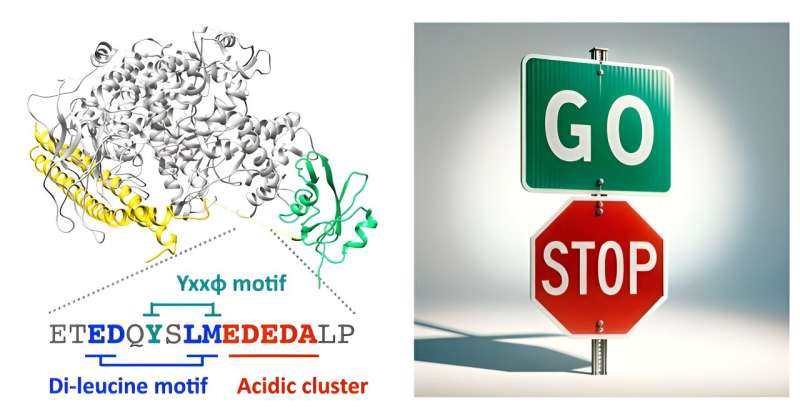
"Il joue un rôle essentiel dans la migration et l'invasion cellulaire, ce qui, lorsqu'il est dérégulé, peut provoquer de nombreuses pathologies. Nos travaux ont révélé que PI3K peut également restreindre activement ces mêmes processus migratoires grâce à un mécanisme endocytaire non catalytique distinct provenant de sa sous-unité p85β. "
En utilisant une combinaison de bioinformatique, de modélisation moléculaire, d'essais de liaison biochimique et d'imagerie de cellules vivantes, Matsubayashi et ses collègues démontrent qu'une région désordonnée au sein du domaine inter-SH2 de p85β se lie directement à la protéine endocytaire AP2. Cette partie de PI3K peut activer un processus cellulaire qui attire certaines molécules dans la cellule, et ce sans avoir besoin de la fonction typique de modification des lipides de l'enzyme.
Lorsque les chercheurs ont perturbé la liaison, le p85β muté n’a pas fonctionné comme il le devrait. Au lieu de réguler le mouvement cellulaire grâce à son mécanisme de freinage, il s’accumule dans des sites spécifiques de la cellule. Cela conduit les cellules à se déplacer plus rapidement et de manière plus persistante, indiquant une perte du contrôle du mécanisme de freinage sur la migration cellulaire.
"Remarquablement, cette enzyme PI3K unique possède des pédales d'accélérateur et de frein opposées intégrées dans sa structure moléculaire", ajoute Matsubayashi. "Le mécanisme endocytaire aide à réguler l'activité de PI3K afin de garantir que le mouvement cellulaire est contrôlé au bon moment et aux bons endroits pour les processus biologiques importants."
Ce rôle de freinage s’est avéré spécifique à la seule sous-unité p85β. Et puisque la sous-unité p85β de PI3K est liée à des propriétés favorisant le cancer, une compréhension plus approfondie de la régulation de PI3K et de sa spécificité isoforme pourrait conduire à de nouvelles stratégies thérapeutiques, telles que celles qui inhibent sélectivement l'aspect cancéreux de PI3K tout en préservant les fonctions normales de PI3K. dans les cellules saines.
Plus d'informations : Hideaki T. Matsubayashi et al, Rôle non catalytique de la phosphoinositide 3-kinase dans la migration des cellules mésenchymateuses par induction non canonique de l'endocytose médiée par p85β/AP2, Nature Communications (2024). DOI :10.1038/s41467-024-46855-y
Informations sur le journal : Communications naturelles
Fourni par l'Université du Tohoku