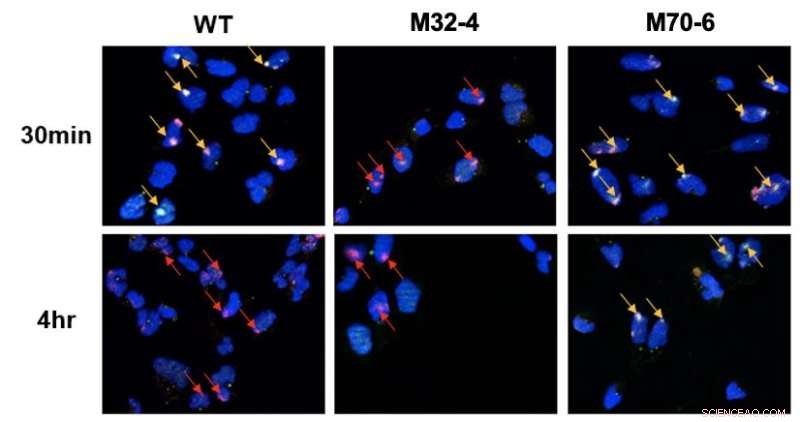
Rôle distinct des interactions de RPA32 et RPA70 avec XPA dans NER. Les cellules ont été irradiées aux UV et la colocalisation de XPA avec les sites de dommages UV a été visualisée par microscopie à fluorescence. Les dommages à l'ADN sont mis en évidence par des flèches rouges et la co-localisation de XPA avec l'ADN UV est indiquée par des flèches jaunes. Dans les cellules mutantes XPA-RPA32 (M32-4), une réduction du recrutement de XPA aux dommages à l'ADN a été observée. Dans les cellules mutantes XPA-RPA70 (M70-6), XPA est resté lié aux sites endommagés pendant une période prolongée. Cela indique que l'interaction RPA32 avec XPA est nécessaire pour le recrutement de XPA aux dommages induits par les UV, tandis que l'interaction RPA70 avec XPA est importante pour le positionnement de XPA pour l'achèvement du NER. Crédit :Institut des sciences fondamentales
La réparation par excision de nucléotide (NER) est une voie majeure de réparation de l'ADN conservée, qui répare divers types de dommages dans le génome, tels que ceux induits par la lumière ultraviolette et les agents environnementaux. Le dysfonctionnement de cette voie peut être préjudiciable à la santé humaine. Par exemple, les personnes présentant des défauts du NER souffrent de xeroderma pigmentosum, une maladie caractérisée par une disposition extrême au cancer de la peau induit par la lumière du soleil en raison d'une incapacité à réparer l'ADN endommagé par les UV.
Alors que le NER contrecarre ainsi la formation de cancer, il est également important pour la thérapie antitumorale. De nombreux agents antitumoraux, tels que le cisplatine, induisent des dommages à l'ADN qui peuvent être réparés par NER. Dans ce contexte, la NER est une cible médicamenteuse d'intérêt pour améliorer les résultats des traitements contre le cancer. Au niveau moléculaire, le NER est une machine moléculaire hautement complexe et dynamique, impliquant plus de 30 protéines qui s'assemblent au niveau des lésions de l'ADN pour exciser les dommages et les remplacer par de l'ADN intact. Ce processus est guidé par les interactions protéine-protéine et protéine-ADN.
Une équipe de chercheurs dirigée par le directeur associé Orlando D. Schärer et l'étudiant diplômé Kim Mihyun du Centre pour l'intégrité génomique de l'Institut des sciences fondamentales de Corée du Sud ont exploré ces interactions. L'équipe a découvert que deux protéines clés du NER, à savoir la protéine A de xeroderma pigmentosum (XPA) et la protéine de réplication A (RPA), sont nécessaires pour organiser le complexe de pré-incision dans le NER.
Les deux protéines XPA et RPA sont responsables de l'organisation du complexe NER après qu'il a trouvé les dommages dans l'ADN. La présente étude a comparé des variantes mutantes de ces deux protéines pour étudier comment les deux protéines s'engagent dans une interaction essentielle pour la voie NER. Plus précisément, il a été découvert que deux interfaces d'interaction entre XPA et RPA sont essentielles pour le NER et ont des rôles distincts dans la voie. L'interaction de XPA avec RPA32 est cruciale pour l'association initiale de XPA avec des dommages à l'ADN, tandis que l'interaction entre XPA et RPA70 est importante pour l'achèvement de NER.
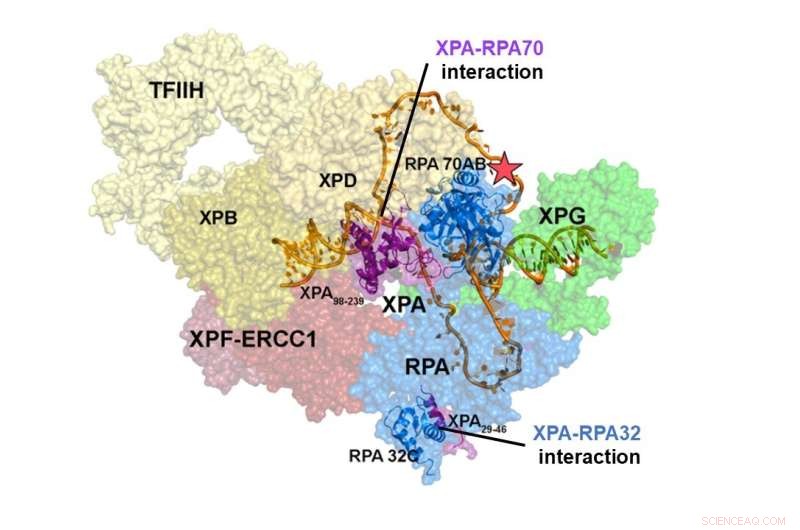
Structure du complexe de pré-incision NER. L'interaction de XPA et RPA70 est localisée au centre du complexe NER, tandis que le site d'interaction de XPA et RPA32 est à la périphérie. Les interactions entre XPA et RPA70 stabilisent le complexe de pré-incision et resserrent l'ADN pour qu'il prenne une forme en U, qui semble être la forme active du complexe, lui permettant d'éliminer les dommages à l'ADN. Crédit :Institut des sciences fondamentales
Des études structurelles intégratives d'un complexe XPA-RPA-ADN ont révélé comment les interactions des deux protéines façonnent le complexe NER et déclenchent l'excision des dommages. L'interaction de XPA et RPA32 se produit à la périphérie du complexe, où elle facilite l'assemblage initial des protéines sur le site de la lésion. L'interaction entre XPA et RPA70 est située au cœur du complexe NER et force l'ADN en forme de U. Cela permet aux deux jonctions ss/dsDNA de se localiser à proximité, permettant au complexe NER d'inciser l'ADN pour éliminer les dommages.
Schärer a déclaré que leur "étude a révélé un nouveau modèle surprenant du complexe NER et comment l'interaction entre XPA et RPA façonne son architecture. La perturbation de l'interaction entre XPA et RPA inhibe le NER, et notre étude fournit un schéma directeur de la façon dont cette interaction peut être ciblées par de petites molécules pour améliorer le traitement du cancer. Nous poursuivons nos recherches de suivi avec notre collaborateur de longue date sur ce projet, le professeur Walter Chazin de l'Université Vanderbilt."
Cette recherche a été publiée dans Proceedings of the National Academy of Sciences . Les étiquettes moléculaires révèlent comment les lysosomes endommagés sont sélectionnés et marqués pour la clairance