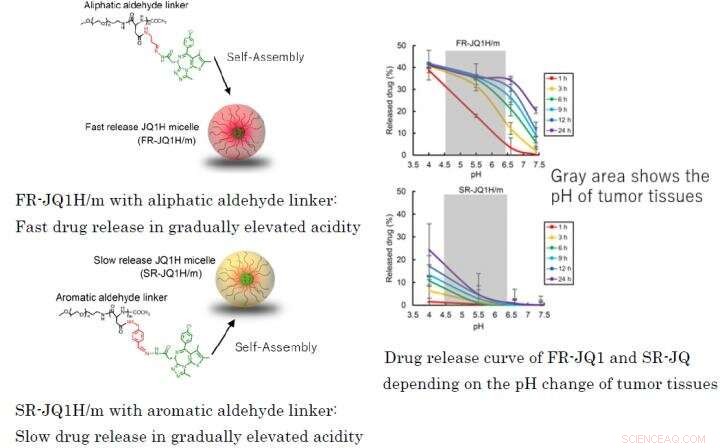
Fig. 1 :Différents profils de libération de médicament en fonction du lieur utilisé pour les copolymères séquencés de nano-micellesFR-JQ1H/m avec un lieur aldéhyde aliphatique :Libération rapide du médicament en cas d'acidité progressivement élevéeSR-JQ1H/m avec un lieur aldéhyde aromatique :Libération lente du médicament en acidité progressivement élevéeCourbe de libération du médicament de FR-JQ1 et SR-JQ en fonction du changement de pH des tissus tumoraux Crédit :2021 Innovation. Centre de NanoMédecine
Le Centre d'innovation de la nanomédecine a rapporté dans ACS Nano avec le groupe du professeur Yu Matsumoto d'oto-rhino-laryngologie et de chirurgie de la tête et du cou et le groupe du professeur Horacio Cabral du département de bioingénierie de l'Université de Tokyo que l'efficacité des nano-micelles polymères avec différents profils d'activation médicamenteuse dépend de la niveau d'expression de c-Myc, l'un des principaux proto-oncogènes, a été développé.
Il est connu que c-Myc est impliqué dans la prolifération des cellules cancéreuses et l'angiogenèse et modifie le cycle cellulaire, supprime la différenciation cellulaire normale, et favorise les métastases cancéreuses. C'est un proto-oncogène typique qui régule de nombreux gènes liés aux facteurs de croissance et est connu pour être impliqué dans le développement de nombreux cancers, comme la translocation chromosomique dans le lymphome de Burkitt. Par conséquent, des recherches sur la découverte de médicaments sont menées dans le monde entier en tant que médicament anticancéreux ciblant ce facteur de transcription qui peut attaquer directement les cellules souches cancéreuses. Cependant, puisque la létalité embryonnaire se produit chez les souris knock-out c-Myc, c-Myc est considéré comme un gène essentiel pour les cellules vivantes, et la livraison sélective aux tissus cancéreux est une clé importante pour développer ses inhibiteurs. Outre, c-Myc est également connu comme un facteur nécessaire à l'induction initiale des cellules iPS. À l'avenir, on peut s'attendre à ce que cette inhibition soit appliquée en tant que technologie pouvant également être utilisée pour supprimer la carcinogenèse dérivée des cellules iPS.
Dans cette étude, JQ1H, qui est un analogue structurel de JQ1H, un inhibiteur indirect typique de c-Myc, a été encapsulé à l'intérieur de nano-micelles fonctionnelles, et leur efficacité a été évaluée. JQ1 se lie à une protéine bromodomaine appelée BRD4, qui est impliquée dans l'activation de l'ARN polymérase II régulant l'expression de c-Myc, pour inhiber fortement ce flux. Par conséquent, l'activité de l'ARN polymérase est affaiblie et l'expression de c-Myc est régulée à la baisse. Bien que JQ1 soit considéré comme un médicament épigénomique prometteur en raison de sa forte inhibition de l'expression des gènes, il a une demi-vie extrêmement courte in vivo en raison de son excrétion rénale rapide et de sa clairance rapide après administration. En outre, JQ1 est presque insoluble dans l'eau. Ces propriétés de JQ1 sont devenues de gros problèmes pour en faire un médicament efficace. Les nano-micelles polymères développées jusqu'à présent au Centre d'innovation de la nanomédecine (iCONM), pour la thérapie anticancéreuse, démontré (1) la stabilisation des médicaments encapsulés, (2) suppression de l'excrétion rénale, (3) EPR (administration sélective de médicaments aux tissus cancéreux) médiée par l'accumulation de tumeurs, et (4) libération de médicament basée sur l'acidose tumorale. Cette fois, nous avons confirmé une bonne activité antitumorale chez des souris transplantées avec un cancer de la langue, mélanome et cancer du pancréas en utilisant des nano-micelles équipées de JQ1.
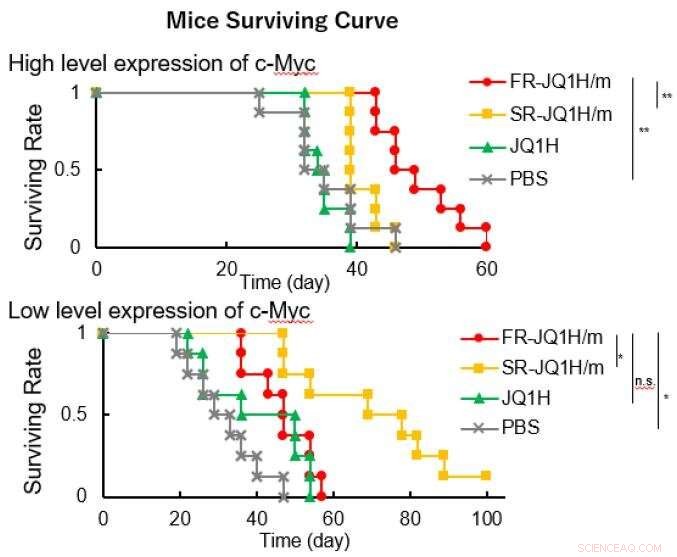
supérieur :cancer de la langue, inférieur :cancer du pancréas. Crédit :2021 Centre d'innovation de la nanomédecine
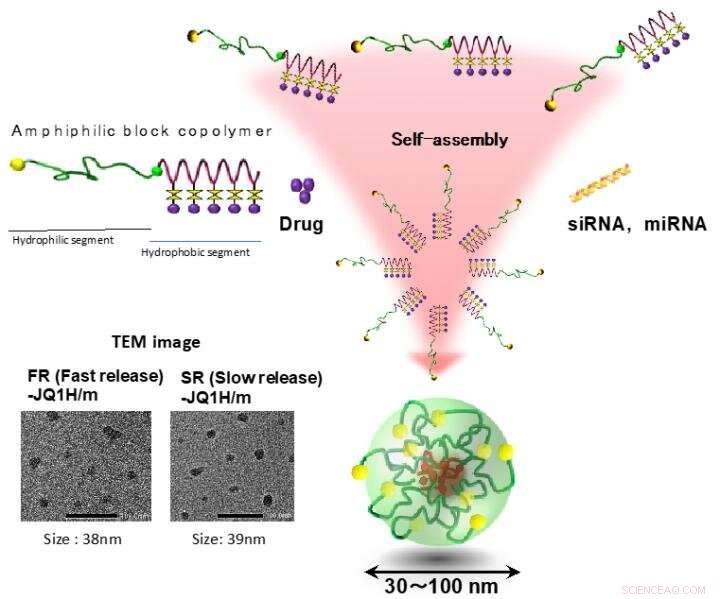
Les micelles polymères ont été l'un des premiers auto-assemblages de polymères signalés comme nano-DDS, et sont composés de deux domaines distincts, un noyau de chargement de médicament et une coque hydrophile. Copolymères à blocs amphiphiles, contenant un bloc hydrophile et un bloc hydrophobe, sont d'abord révélés construire ces domaines distincts dans une structure micellaire par auto-assemblage spontané à la suite d'interactions hydrophobes en milieu aqueux. H. Cabral, K. Miyata, K. Osada, K. Kataoka, "Les micelles de copolymères blocs dans les applications en nanomédecine" Chem. Rév. 2018, 118 6844-6892. (DOI :10.1021/acs.chemrev.8b00199). Crédit :2021 Centre d'innovation de la nanomédecine
Des nano-micelles contenant du JQ1H s'infiltrent dans le tissu tumoral à partir des vaisseaux sanguins après administration systémique en raison de l'effet EPR. Les tissus tumoraux sont riches en acide lactique en raison de sa glycolyse améliorée et sont plus acides que les tissus normaux. Dans ce travail, deux types de nano-micelles ont été préparés; l'un dans lequel JQ1H hydrophobe était lié à un polymère séquencé amphiphile composé d'un bloc polyéthylène glycol hydrophile et d'un bloc poly-aminoacide hydrophobe utilisant un linker 3-aminopropionaldéhyde (aldéhyde aliphatique) et l'autre micelle dans laquelle JQ1H était lié au polymère via le p-aminométhylbenzaldéhyde ( aldéhyde aromatique). Un polymère bloc amphiphile a été synthétisé et utilisé comme matériau de base pour les nano-micelles. Lorsqu'il a été auto-assemblé dans l'eau en une structure micellaire et administré à des souris porteuses de cancer, l'activité antitumorale a été atteinte.
Lorsque le linker est un aldéhyde aliphatique ou lorsqu'il s'agit d'un aldéhyde aromatique, le schéma de libération du médicament diffère grandement en fonction de l'acidité. Le premier libère le médicament rapidement, et ce dernier libère le médicament lentement. Par conséquent, la première nano-médecine s'appelait FR-JQ1H/m et la seconde SR-JQ1H/m. L'activité antitumorale de ces nano-micelles diffère fortement selon le niveau d'expression de c-Myc. Tandis que, FR-JQ1H/m est plus efficace pour les tumeurs à forte expression de c-Myc, SR-JQ1H/m est plus efficace pour les tumeurs avec une faible expression de c-Myc.
À l'avenir, nous pensons que la sélection de nano-micelles en fonction du niveau d'expression des biomarqueurs sera une étape importante vers la réalisation d'une médecine personnalisée et d'hôpitaux intra-corporels.