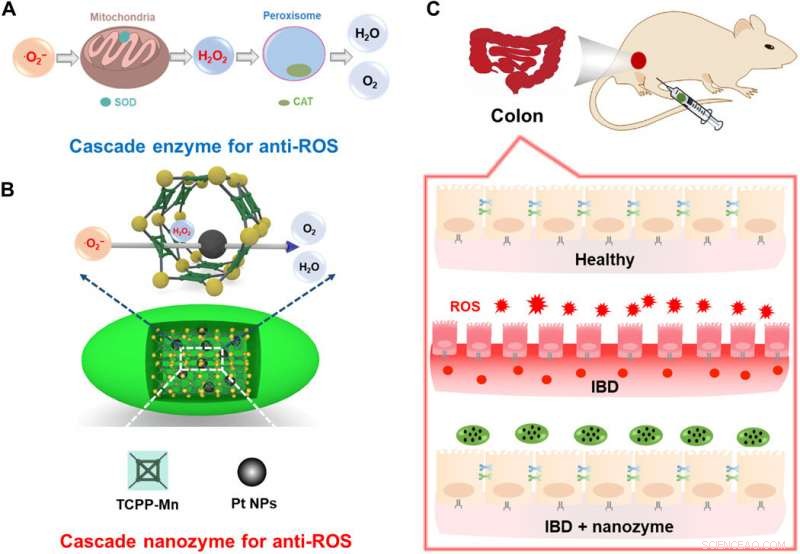
Illustration schématique de la conception d'un nanozyme intégré avec une activité anti-ROS en cascade pour le traitement des MII. (A) Enzymes en cascade cellulaire pour les anti-ROS. L'efficacité thérapeutique d'un tel système est limitée en raison des différentes localisations subcellulaires des enzymes SOD et CAT et de la stabilité extracellulaire limitée. (B) Construction d'un nanozyme en cascade pour la thérapie anti-ROS en incorporant des NP de Pt à l'intérieur de PCN222-Mn MOF. La proximité à l'échelle nanométrique des sites actifs catalytiques favorise les réactions en cascade. (C) La MII des souris peut être efficacement soulagée grâce à un traitement avec le nanozyme en cascade intégré. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abb2695
Dans un récent rapport, Yufeng Liu et une équipe de chercheurs interdisciplinaires en Chine ont développé une cascade de nanoenzymes intégrée pour éliminer les espèces réactives excessives de l'oxygène (ROS ; radicaux libres d'oxygène). Le nanozyme imitait la superoxyde dismutase (un groupe d'enzymes) et incorporait une structure métal-organique (MOF) à base de manganèse (Mn) pour transformer les radicaux oxygène en peroxyde d'hydrogène (H
Au cours des réactions catalytiques en cascade qui se produisent dans les organismes vivants, plusieurs enzymes sont combinées à l'intérieur de compartiments subcellulaires pour une transduction précise du signal et un métabolisme efficace. De telles réactions en cascade confinées sont avantageuses par rapport aux réactions classiques à plusieurs étapes en raison des barrières de diffusion réduites et des concentrations locales améliorées d'intermédiaires pour une économie d'atomes et des réactions totales améliorées. Les scientifiques ont fait des efforts considérables pour imiter de tels systèmes en cascade sur des échafaudages, mais leur coût élevé et leur faible stabilité ont des applications pratiques étendues limitées. Par conséquent, les chercheurs ont exploré les imitateurs d'enzymes pour comprendre et construire des réactions en cascade en laboratoire. Dans ce travail, Liu et al. ont détaillé un système de réaction en cascade à base de nanoenzymes à un seul composant avec une activité élevée et ont démontré leur rôle au cours de la thérapie in vivo des maladies inflammatoires de l'intestin (MICI) associées aux espèces réactives de l'oxygène (ROS).
Concevoir, synthèse et caractérisation de l'échafaudage enzymatique
L'équipe a conçu et synthétisé un nanozyme en cascade mimétique intégré de superoxyde dismutase (SOD) et catalase (CAT) et l'a désigné sous le nom de Pt@PCN222-Mn. Pour construire l'échafaudage, ils ont introduit une fraction de type SOD de porphyrine de manganèse (Mn) (III) et une nanoparticule de platine de type CAT dans un cadre organique métallique (MOF) à base de zirconium (Zr) à l'échelle nanométrique nommé PCN222. La construction intégrée (Pt@PCN222-Mn) a montré une activité améliorée de piégeage des ROS pour protéger les souris des MII liées aux ROS, une maladie chronique incurable encore, et ainsi élargir le potentiel des nanozymes en cascade pour des applications biomédicales in vivo.
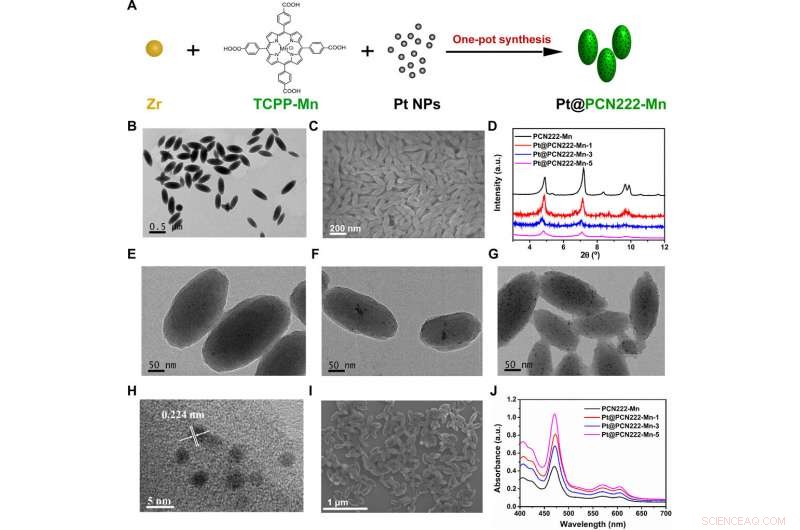
Synthèse et caractérisation structurale du Pt@PCN222-Mn et des matériaux associés. (A) Procédure de synthèse de Pt@PCN222-Mn. (B) Images au microscope électronique à transmission (MET) et (C) Images au microscope électronique à balayage (MEB) de PCN222-Mn. (D) Diagrammes de diffraction des rayons X sur poudre (PXRD) de PCN222-Mn, Pt@PCN222-Mn-1, Pt@PCN222-Mn-3, et Pt@PCN222-Mn-5. Images MET de (E) Pt@PCN222-Mn-1, (F) Pt@PCN222-Mn-3, et (G) Pt@PCN222-Mn-5. (H) Images MET haute résolution et (I) SEM de Pt@PCN222-Mn-5. (J) Spectres d'absorption du PCN222-Mn, Pt@PCN222-Mn-1, Pt@PCN222-Mn-3, et Pt@PCN222-Mn-5. a.u., unités arbitraires. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abb2695
Lors des expérimentations, Liu et al. a confirmé la synthèse réussie des constructions préliminaires à base de manganèse en utilisant la résonance magnétique nucléaire, Spectroscopie infrarouge à transformée de Fourier et mesures spectroscopiques ultraviolet visible. L'équipe a synthétisé le composant contenant un MOF nanométrique et confirmé sa formation par microscopie électronique à transmission (MET) et microscopie électronique à balayage (MEB). Les scientifiques ont ensuite développé trois nanozymes en cascade et les ont appelés Pt@PCN222-Mn-1, Pt@PCN222-Mn-3 et Pt@PCN222-Mn-5, respectivement. Parmi ceux-ci, Pt@PCN222-Mn-5 avait une surface spécifique plus élevée par rapport aux autres nanozymes anti-ROS étudiés jusqu'à présent.
Étude de l'activité catalytique des nanozymes en cascade
Piégeage des radicaux oxygène (
•
O
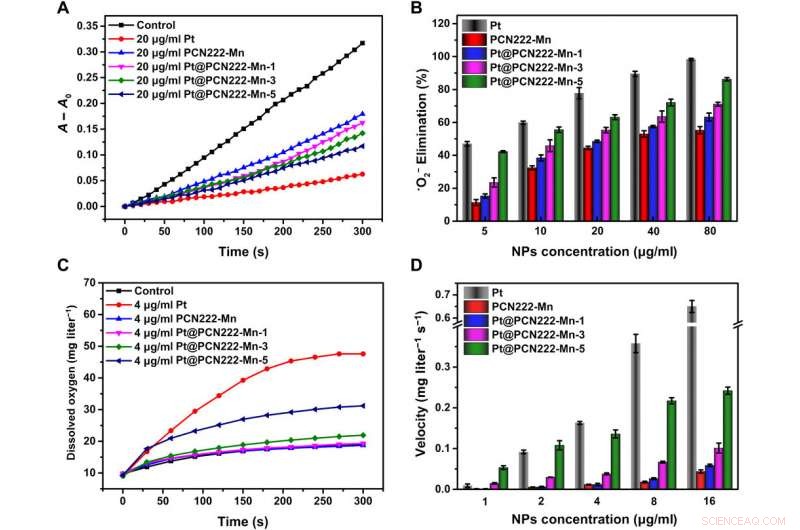
Activités de nettoyage des ROS de Pt@PCN222-Mn et des matériaux associés. (A) Courbes cinétiques typiques de A − A0 (550 nm) pour le suivi de la réduction du NBT avec X et XO en l'absence et en présence de Pt, PCN222-Mn, Pt@PCN222-Mn-1, Pt@PCN222-Mn-3, et Pt@PCN222-Mn-5. (B) Dépendance entre l'efficacité d'élimination de •O2− et les concentrations de nanozymes. (C) Courbes cinétiques typiques de génération d'oxygène à partir de la décomposition de H2O2 (50 mM) en présence de Pt, PCN222-Mn, Pt@PCN222-Mn-1, Pt@PCN222-Mn-3, et Pt@PCN222-Mn-5. (D) Dépendance entre les vitesses de production d'oxygène dans les 60 premières s et les concentrations de nanozymes. Les données sont présentées sous forme de moyennes ± SD (n =3). Crédit :Avancées scientifiques, doi:10.1126/sciadv.abb2695
En tant que deuxième étape cruciale de la cascade de piégeage des ROS dans les environnements biologiques, l'enzyme CAT (catalase) a catalysé la décomposition du peroxyde d'hydrogène (H
Focus enzyme Pt@PCN222-Mn-5 et thérapie anti-inflammatoire in vivo
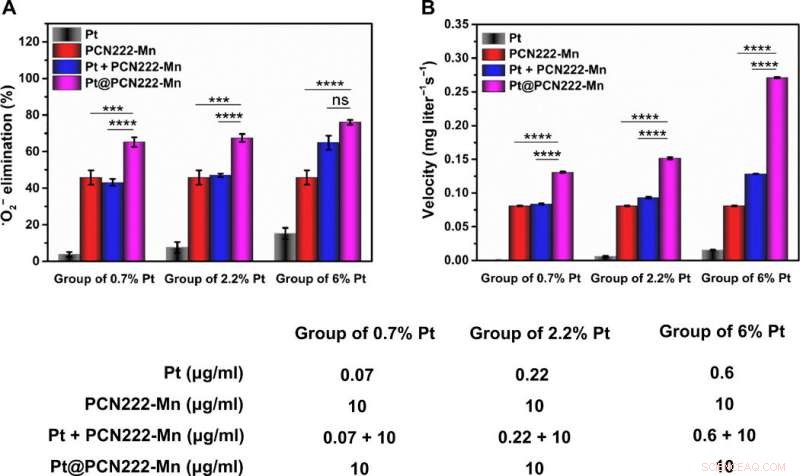
Pour bien comprendre l'activité du nanozyme en cascade Pt@PCN222-Mn-5, l'équipe a étudié son activité enzymatique synergique de type SOD et CAT et a observé des effets synergiques prononcés pour cette dernière. L'équipe a choisi le nanozyme pour des investigations plus approfondies et a testé sa fonctionnalité avec une lignée cellulaire lors d'études de cytotoxicité. A une concentration inférieure à 80 µg/mL, le nanozyme n'a montré aucune cytotoxicité et a démontré un excellent potentiel de balayage des espèces réactives de l'oxygène.
Activité synergique de piégeage des ROS de Pt@PCN222-Mn-5. (A) Efficacité d'élimination de •O2− avec différentes concentrations de Pt, PCN222-Mn, Pt + PCN222-Mn, et Pt@PCN222-Mn. (B) Vitesses de production d'oxygène dans les 60 premières s, avec différentes concentrations de Pt, PCN222-Mn, Pt + PCN222-Mn, et Pt@PCN222-Mn. Les données sont présentées sous forme de moyennes ± SD (n =3). ***P <0,005 et ****P <0,001 ; ns, insignifiant; t teste. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abb2695
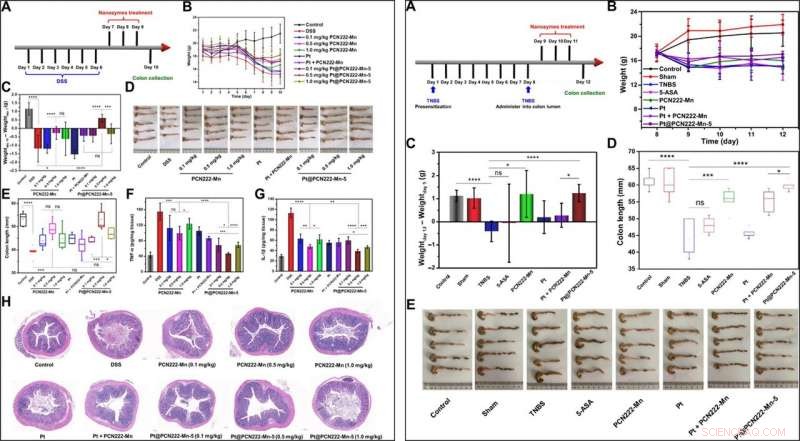
Sur la base des résultats expérimentaux, Liu et al. ont mené des thérapies in vivo pour traiter la colite ulcéreuse (CU) et la maladie de Crohn (MC) dans des modèles murins de la maladie. Étant donné que la CU est une forme de trouble inflammatoire de l'intestin qui s'accompagne généralement d'espèces réactives de l'oxygène surproduites, les scientifiques ont testé les effets thérapeutiques du Pt@PCN222-Mn-5 avec des médicaments existants pour le traitement des MII. L'équipe a administré le traitement par injection intrapéritonéale à chaque souris et a observé des effets thérapeutiques réussis de Pt@PCN222-Mn-5 pour soulager l'état pathologique de la CU chez la souris. L'équipe a optimisé les doses du nanozyme en cascade en utilisant plusieurs groupes de traitement et a trouvé que l'enzyme cible d'intérêt était la plus favorable. Lorsqu'ils ont exploré de la même manière le CD, un autre type de MII utilisant un modèle murin induit par la maladie, la stratégie de traitement a indiqué une plus grande efficacité pour les nanozymes en cascade par rapport aux médicaments traditionnels à petites molécules utilisés dans le traitement des MII.
GAUCHE :thérapie de la CU avec Pt@PCN222-Mn-5. (A) Procédure globale de l'expérimentation animale (colite induite par le DSS). (B) Développement quotidien du poids corporel pendant 10 jours. (C) Modifications du poids corporel des souris avant (jour 7) et après les traitements indiqués (jour 10). (D) Images des côlons et (E) les longueurs de côlon correspondantes dans les groupes indiqués. (F) IL-1β et (G) niveaux de TNF-α dans les homogénats de côlon des groupes indiqués. (H) Sections coliques colorées H&E de souris des groupes indiqués au jour 10. Les données sont présentées sous forme de moyennes ± SD (n =5). *P <0,05, **P <0,01, ***P <0,005, et ****P <0,001 ; ns, insignifiant; t teste. Crédit photo (D) :Yufeng Liu, Faculté d'ingénierie et des sciences appliquées, Université de Nankin. DROITE :thérapie CD avec Pt@PCN222-Mn-5. (A) Procédure globale de l'expérimentation animale [2, 4, Colite induite par l'acide 6-trinitrobenzène sulfonique (TNBS)]. (B) Développement quotidien du poids corporel après administration d'une solution de TNBS dans la lumière du côlon. (C) Modifications du poids corporel des souris avant (jour 9) et après les traitements indiqués (jour 12). (D) Longueurs des deux points et (E) les images correspondantes des deux points des groupes indiqués. Les données sont présentées sous forme de moyennes ± SD (n =5). *P <0,05, ***P <0,005, et ****P <0,001 ; ns, insignifiant; t teste. Crédit photo (E) :Yuan Cheng, Faculté d'ingénierie et des sciences appliquées, Université de Nankin. Crédit :Avancées scientifiques, doi:10.1126/sciadv.abb2695
De cette façon, Yufeng Liu et ses collègues ont développé un nanozyme intégré pour catalyser les réactions en cascade et éliminer les espèces réactives de l'oxygène (ROS). Le nanozyme intégré avait deux sites actifs séparés dans l'espace pour imiter la superoxyde dismutase (SOD) et la catalase (CAT). À l'aide d'expériences en laboratoire, ils ont montré l'activité exceptionnelle d'élimination des ROS du nanozyme en cascade, leur excellente biocompatibilité et leur bonne dispersibilité aqueuse. L'équipe a établi un modèle animal inflammatoire pour tester la capacité anti-ROS du nanozyme en cascade dans un organisme biologique et a déterminé son potentiel thérapeutique supérieur contre les modèles de colite ulcéreuse (CU) et de maladie de Crohn (MC) de troubles inflammatoires de l'intestin (MICI). L'équipe a optimisé la concentration du nanozyme pour obtenir un soulagement efficace des MII dans des modèles animaux. Le travail a montré d'excellentes activités de piégeage des ROS pour le traitement de l'inflammation et fournit une méthode prometteuse pour construire des nanozymes avec de multiples sites actifs pour d'autres applications en biomédecine.
© 2020 Réseau Science X