La valence est une mesure de la réactivité d'un atome ou d'une molécule. Vous pouvez dériver la valence de nombreux éléments en regardant leur position dans le tableau périodique, mais ce n'est pas vrai pour tous. Il est également possible de calculer la valence d'un atome ou d'une molécule en notant comment il se combine avec d'autres atomes ou molécules avec des valences connues.
La règle d'octet
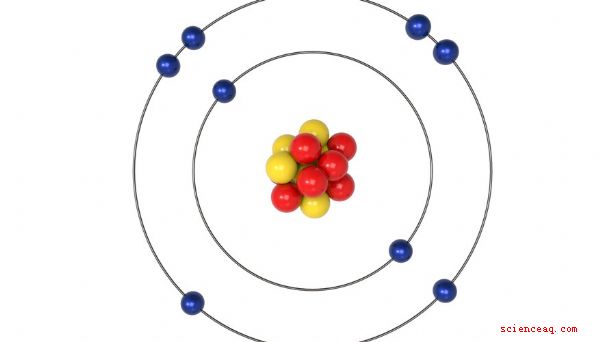
Lors de la détermination de la valence d'un atome ou d'une molécule (une pour que vous ne pouvez pas utiliser le tableau périodique pour déterminer la valence), les chimistes utilisent la règle d'octet. Selon cette règle, les atomes et les produits chimiques se combinent de manière à produire huit électrons dans l'enveloppe extérieure de tout composé qu'ils forment. Une enveloppe extérieure avec huit électrons est pleine, ce qui signifie que le composé est stable.
Lorsqu'un atome ou une molécule a de un à quatre électrons dans sa coquille extérieure, il a une valence positive, ce qui signifie qu'il donne ses électrons libres . Lorsque le nombre d'électrons est de quatre, cinq, six ou sept, vous déterminez la valence en soustrayant le nombre d'électrons de 8. C'est parce qu'il est plus facile pour l'atome ou la molécule d'accepter des électrons pour atteindre la stabilité. Tous les gaz nobles - à l'exception de l'hélium - ont huit électrons dans leur enveloppe extérieure et sont chimiquement inertes. L'hélium est un cas spécial - il est inerte, mais il n'a que deux électrons dans sa coquille la plus externe.
Le tableau périodique
Les scientifiques ont organisé tous les éléments qui sont actuellement connus dans un tableau appelé le tableau périodique et, dans de nombreux cas, vous pouvez déterminer la valence en consultant le graphique. Par exemple, tous les métaux de la colonne 1, y compris l'hydrogène et le lithium, ont une valence de +1, tandis que tous ceux de la colonne 17, y compris le fluor et le chlore, ont une valence de -1. Les gaz nobles de la colonne 18 ont une valence de 0 et sont inertes.
Vous ne pouvez pas trouver la valence du cuivre, de l'or ou du fer en utilisant cette méthode car ils ont plusieurs coques d'électrons actifs. Cela est vrai pour tous les métaux de transition dans les colonnes 3 à 10, les éléments les plus lourds dans les colonnes 11 à 14, les lanthanides (éléments 57-71) et les actinides (éléments 89-103).
Détermination de la valence à partir de formules chimiques
Vous pouvez déterminer la valence d'un élément de transition ou d'un radical dans un composé particulier en notant comment il se combine avec des éléments avec une valence connue. Cette stratégie est basée sur la règle des octets, qui nous dit que les éléments et les radicaux se combinent pour produire une enveloppe externe stable de huit électrons.
Comme illustrations simples de cette stratégie, notez que le sodium (Na), avec une valence de +1, se combine facilement avec le chlore (Cl), qui a une valence de -1, pour former du chlorure de sodium (NaCl), ou sel de table. Ceci est un exemple de réaction ionique dans laquelle un électron est donné par un atome et accepté par l'autre. Cependant, il faut deux atomes de sodium pour se combiner ioniquement avec le soufre (S) pour former du sulfure de sodium (Na 2S), un sel fortement alcalinisant utilisé dans l'industrie de la pâte à papier. Parce qu'il faut deux atomes de sodium pour former ce composé, la valence du soufre doit être -2. Pour appliquer cette stratégie à des molécules plus complexes, il est important de réaliser d'abord que les éléments se combinent parfois pour former des radicaux réactifs qui n'ont pas pas encore atteint une enveloppe extérieure stable de huit électrons. Un exemple est le radical sulfate (SO 4). Il s'agit d'une molécule tétraédrique dans laquelle l'atome de soufre partage des électrons avec quatre atomes d'oxygène dans ce qu'on appelle une liaison covalente. Dans un tel composé, vous ne pouvez pas dériver la valence des atomes dans le radical en regardant la formule. Vous pouvez cependant déterminer la valence du radical par les composés ioniques qu'il forme. Par exemple, le radical sulfate se combine ioniquement avec l'hydrogène pour former de l'acide sulfurique (H 2SO 4). Cette molécule contient deux atomes d'hydrogène, chacun avec une valence connue de +1, donc dans ce cas, la valence du radical est -2. Une fois que vous avez déterminé la valence du radical, vous pouvez l'utiliser pour calculer la valence d'autres éléments et molécules avec lesquels il se combine. Par exemple, le fer (Fe) est un métal de transition qui peut présenter plusieurs valences. Lorsqu'il se combine avec le radical sulfate pour former du sulfate ferreux, FeSO 4, sa valence doit être de +2, car la valence du radical sulfate, déterminée par la liaison qu'il forme avec l'hydrogène, est de -2.