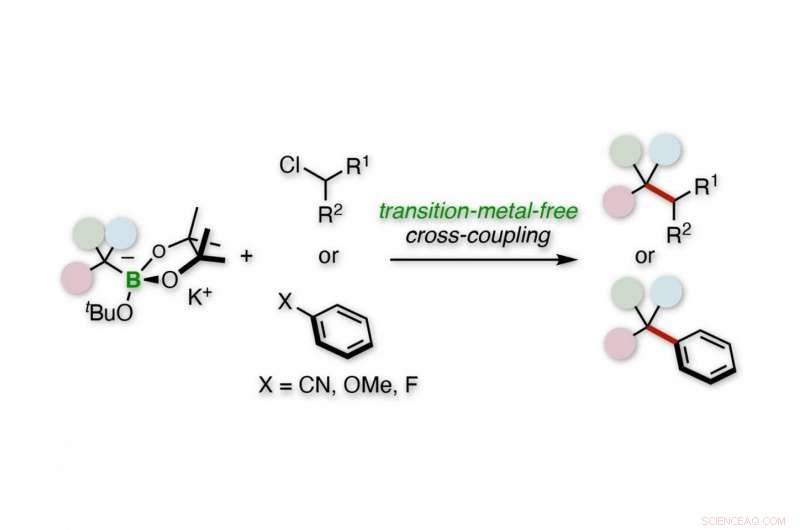
Couplage croisé alkylatif tertiaire d'électrophiles alkyles ou aryles. Crédit :Université de Kanazawa
Médicaments, plastiques, et de nombreux autres produits chimiques ont transformé la vie humaine. Pour préparer ces produits, les chimistes utilisent souvent un catalyseur, souvent à base de métaux rares, à différents moments de leurs synthèses. Bien que les catalyseurs de métaux rares soient incroyablement utiles, leur offre limitée signifie que leur utilisation n'est pas durable à long terme. Les chimistes synthétiques ont besoin d'une alternative.
Dans une étude publiée récemment dans Angewandte Chemie , des chercheurs de l'Université de Kanazawa rapportent une telle alternative. Leurs recherches sur une large classe de réactions chimiques qui sont courantes dans les synthèses pharmaceutiques et autres ouvriront la voie à une industrie chimique plus durable.
Le prix Nobel de chimie 2010 a été décerné à des chercheurs qui ont utilisé des catalyseurs à base de palladium métallique pour effectuer un type courant de réaction chimique connue sous le nom de couplage croisé. De tels catalyseurs fonctionnent très bien pour synthétiser ce que l'on appelle les centres de carbone quaternaire congestionnés, qui sont communs dans les molécules utilisées en agriculture et en médecine. Cependant, pour une durabilité à long terme, les chercheurs ont besoin d'une alternative aux catalyseurs de métaux rares.
"Nous avons utilisé des organoborates benzyliques pour effectuer un couplage croisé alkylatif tertiaire d'électrophiles aryles ou alkyles, " dit Hirohisa Ohmiya, auteur correspondant de l'étude. "Notre procédure n'utilise pas d'éléments rares et constitue une voie directe vers les centres de carbone quaternaire."
Les études initiales des chercheurs consistaient en un benzylboronate tertiaire qui est d'abord activé par une base d'alcoxyde de potassium pour devenir un anion benzylique. Cet anion subit ensuite une réaction de couplage croisé avec un électrophile de chlorure d'alkyle secondaire.
"La réaction a une large portée, " explique l'auteur correspondant Hirohisa Ohmiya. " Par exemple, le remplacement du groupe phényle du boronate par divers cycles aromatiques a réussi, et l'électrophile peut être une large gamme d'anneaux et de chaînes linéaires."
Des études ultérieures ont remplacé le chlorure d'alkyle secondaire par divers nitriles d'aryle, éthers d'aryle, et les fluorures d'aryle. Beaucoup de ces réactions ont été couronnées de succès, tels que ceux avec la 4-cyanopyridine et le 4-fluorophénylbenzène.
Un commentaire dans La nature le 19 novembre indique que la pandémie de COVID-19 a perturbé les chaînes d'approvisionnement de divers métaux rares pertinents pour l'industrie chimique. Des centaines de mines et d'usines ont été fermées, et de nombreuses frontières nationales sont plus restreintes qu'avant la pandémie. Une solution à long terme aux perturbations de la chaîne d'approvisionnement consiste à développer des protocoles synthétiques qui n'utilisent pas de métaux rares. La recherche décrite ici est une partie importante de cet effort et contribuera à rendre les synthèses chimiques plus durables pour les générations futures.