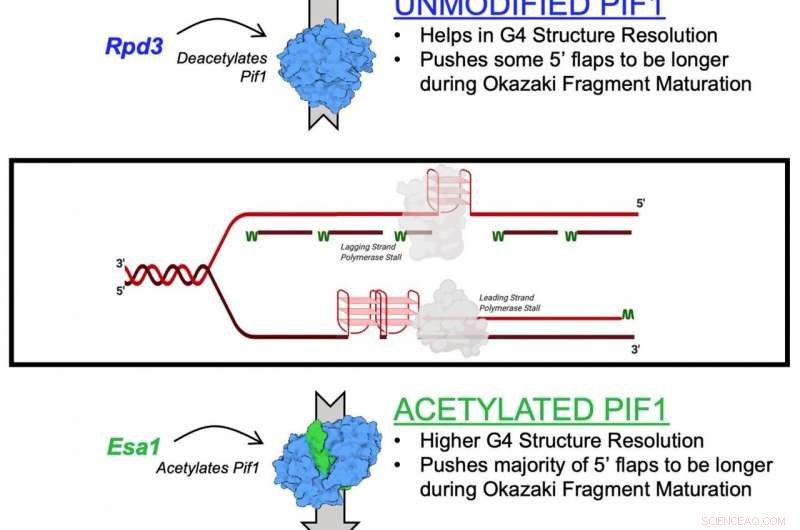
Un diagramme illustrant l'acétylation de l'enzyme hélicase Pif1 Crédit :Matthew Bochman et Lata Balakrishnan, Université de l'Indiana Bloomington/IUPUI
Une nouvelle étude menée par des scientifiques de l'IUPUI et de l'Université d'Indiana Bloomington est la première à décrire un mécanisme biochimique qui augmente l'activité d'une molécule dont la présence est observée dans de nombreux types de cancer.
La molécule, une enzyme appelée Pif1hélicase, joue un rôle dans de nombreux processus cellulaires importants dans le corps. Une régulation étroite de cette protéine est vitale pour la stabilité du génome car trop peu ou trop d'activité peut influencer le vieillissement et les maladies liées à l'âge, principalement le cancer. Un traitement anticancéreux courant, inhibiteurs d'HDAC, peut également déclencher un pic de cette enzyme.
"Actuellement, nous donnons aux gens des médicaments qui augmentent l'activité du Pif sans vraiment savoir comment cela affecte d'autres parties de la cellule qui jouent un rôle dans la stabilité du génome, " dit Lata Balakrishnan, professeur agrégé de biologie à la Faculté des sciences de l'IUPUI, qui est co-auteur principal de l'étude.
« Les inhibiteurs de HDAC régulent à la hausse certains gènes de suppression de tumeurs, et sont donc utilisés dans des thérapies combinées pour traiter des cancers spécifiques, mais quand il s'agit de leur impact sur d'autres parties de la cellule, nous opérons essentiellement dans le noir."
L'autre auteur principal de l'étude est Matthew Bochman, professeur agrégé au Département de biochimie moléculaire et cellulaire de l'IU Bloomington College of Arts and Sciences. Les autres co-auteurs sont Christopher Sausen et Onyekachi E. Ononye, doctorat étudiants des laboratoires de Bochman et de Balakrishnan, respectivement, au moment de l'étude.
Le mécanisme décrit dans l'étude est l'effet de l'acétylation de la lysine sur Pif1. L'acétylation de la lysine se produit lorsqu'une petite molécule appelée groupe acétyle se lie à la lysine, un acide aminé utilisé pour construire des protéines communes dans le corps. Cette action transforme la lysine d'une molécule chargée positivement en une molécule chargée neutre. Cette neutralisation peut impacter la fonction des protéines, stabilité des protéines et interaction protéine-protéine dans les cellules, entre autres.
Les hélicases sont connues sous le nom de « zips » génétiques des cellules, car elles séparent l'ADN dans le but de la réplication et de la réparation génétiques. Ils aident également à maintenir les télomères, la structure à la fin des chromosomes qui raccourcissent avec l'âge.
Dans la nouvelle étude, les chercheurs ont identifié l'acétylation de la lysine sur l'hélicase Pif1 et ont montré que l'ajout du groupe acétyle augmente l'activité de la protéine, ainsi que sa fonction de "décompression". Ils ont également découvert que l'acétylation de la lysine modifie la forme - ou la "conformation" - de la protéine Pif1. Ils pensent que ce changement de forme augmente la quantité d'hélicase Pif1.
"L'interaction dynamique de l'ajout et de l'élimination du groupe acétyle sur la lysine régule une grande variété de protéines dans la cellule, " Balakrishnan a déclaré. " Les perturbations de ce processus peuvent jouer un rôle dans le cancer, vieillissement, des réponses inflammatoires et même des comportements liés à la dépendance. »
"En tant que classe, les hélicases sont impliquées dans de nombreux processus nécessaires à l'intégrité du génome, " Bochman a ajouté. " Tout échec significatif dans ces processus est généralement cancérigène. "
Les détails précis de l'acétylation de la lysine dans Pif1, son effet sur la forme de l'enzyme et l'impact qui en résulte sur l'activité de l'hélicase a pris près de cinq ans pour être observé et rapporté. L'étude, menées en parallèle sur deux campus IU, a été rendu possible grâce à l'expertise complémentaire des scientifiques principaux. En tant que biochimiste ayant déjà étudié l'acétylation de la lysine dans d'autres protéines, Balakrishnan a pu isoler Pif1 in vitro pour observer sa réponse aux réactions chimiques dans un tube à essai. En revanche, en tant que généticien travaillant dans la levure comme organisme modèle pour étudier Pif1, Bochman a pu modifier des cellules in vivo pour observer les réactions se dérouler dans un organisme vivant.
"La capacité à observer ces réactions dans une cellule vivante est souvent plus pertinente, mais c'est aussi beaucoup plus salissant, " Balakrishnan a déclaré. "Nos expériences s'informaient constamment sur la prochaine étape. "
En regardant vers l'avenir, Bochman a déclaré que la connaissance complexe des processus cellulaires, tels que l'acétylation de la lysine, jouerait de plus en plus un rôle dans la thérapie personnalisée.
"Si vous séquencez la tumeur d'un patient, vous pouvez affiner les médicaments pour cibler des enzymes très spécifiques, " at-il dit. " Au lieu d'un médicament qui affecte largement la cellule entière, il sera possible d'adopter une approche ciblée qui réduit les effets secondaires potentiels. Ce niveau de personnalisation est vraiment l'avenir de la biologie du cancer et de la médecine du cancer."