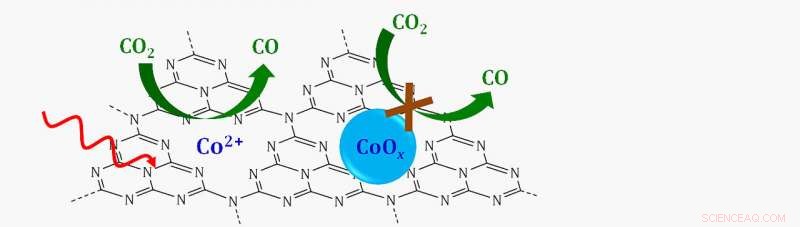
Schéma d'un catalyseur à site unique dans lequel des ions cobalt simples (CO
Une équipe de scientifiques a découvert un site unique, catalyseur activé par la lumière visible qui convertit le dioxyde de carbone (CO
Les scientifiques ont utilisé la National Synchrotron Light Source II, une installation utilisateur du Bureau des sciences du Département de l'énergie des États-Unis (DOE) au Brookhaven National Laboratory, pour découvrir les détails de la réaction efficace, qui a utilisé un seul ion de cobalt pour aider à abaisser la barrière énergétique pour décomposer le CO
Conversion du CO
"Nous avons maintenant la preuve que nous avons fabriqué un catalyseur à site unique. Aucun travail précédent n'a signalé le CO solaire
Briser les liens qui retiennent le CO
"La question est, entre plusieurs catalyseurs possibles, qui sont efficaces et pratiques à mettre en œuvre dans l'industrie ?", a déclaré Frenkel.
Un ingrédient clé requis pour briser les liaisons du CO
"Le défi est de trouver un autre matériau semi-conducteur où l'énergie de la lumière naturelle du soleil fera un match parfait pour expulser les électrons, " a déclaré Frenkel.
Les scientifiques avaient également besoin que le semi-conducteur soit lié à un catalyseur fabriqué à partir de matériaux que l'on pouvait trouver en abondance dans la nature, plutôt que rare, métaux coûteux comme le platine. Et ils voulaient que le catalyseur soit suffisamment sélectif pour conduire uniquement la réaction qui convertit le CO
"Nous ne voulons pas que les électrons soient utilisés pour des réactions autres que la réduction du CO
Ions cobalt liés au nitrure de carbone graphitique (C3N4), un semi-conducteur en carbone, azote, et des atomes d'hydrogène, coché toutes les cases pour ces exigences.
« Il y a eu un intérêt important pour l'utilisation du C3N4 comme semi-conducteur sans métal pour récolter la lumière visible et entraîner des réactions chimiques, " a déclaré Li. "Les électrons générés par le C3N4 sous irradiation lumineuse ont une énergie suffisamment élevée pour réduire le CO
Peipei Huang, chercheur postdoctoral dans le laboratoire de Li, a fabriqué le catalyseur en déposant simplement des ions cobalt sur un matériau C3N4 fabriqué à partir d'urée disponible dans le commerce. L'équipe a ensuite examiné de manière approfondie le catalyseur synthétisé à l'aide de diverses techniques en collaboration avec Christine Caputo de l'Université du New Hampshire et Ronald Grimm du Worcester Polytechnic Institute.
Le catalyseur fonctionnait au CO
"Ce catalyseur a fait ce qu'il était censé faire :décomposer le CO
Frenkel et Li ont donc réfléchi à des expériences qui montreraient la structure du catalyseur avec précision. Des études structurales donneraient aux scientifiques des informations sur le nombre d'atomes de cobalt, leur position par rapport aux atomes de carbone et d'azote, et d'autres caractéristiques que les scientifiques pourraient potentiellement ajuster pour essayer d'améliorer davantage le catalyseur.
Ils se sont tournés vers la ligne de lumière d'absorption et de diffusion rapides des rayons X (QAS) du NSLS-II pour utiliser la spectroscopie d'absorption des rayons X. Avec l'aide du scientifique principal de la ligne de lumière Steven Ehrlich, L'étudiant de Frenkel, Jiahao Huang, a pris les données et analysé les spectres.
Dans cette technique, les rayons X du NSLS-II sont absorbés par les atomes de l'échantillon, qui éjectent alors des ondes d'électrons. Les spectres montrent comment ces ondes électroniques interagissent avec les atomes environnants, semblable à la façon dont les ondulations à la surface d'un lac sont perturbées lorsqu'elles rencontrent des rochers.
"Pour pouvoir faire de la spectroscopie d'absorption des rayons X (XAS), nous devons régler et balayer l'énergie du faisceau de rayons X frappant l'échantillon, " a déclaré Ehrlich. " Chaque élément peut absorber des rayons X à des énergies distinctes, appelés bords d'absorption. Sur la nouvelle ligne de lumière QAS, nous pouvons balayer l'énergie des rayons X à travers l'énergie de bord d'absorption de différents éléments, comme le cobalt dans ce cas. Nous mesurons ensuite le nombre de photons absorbés par l'échantillon pour chaque valeur de l'énergie des rayons X."
En outre, Frenkel a expliqué, "chaque type d'atome produit un type différent d'ondulation électronique, lorsqu'il est excité par les rayons X, ou lorsqu'il est touché par d'autres ondulations, Ainsi, le spectre d'absorption des rayons X vous indique ce que sont les atomes environnants, ainsi que leur distance et leur nombre."
L'analyse a montré que le catalyseur décomposant le CO
"Il n'y avait pas de paires cobalt-cobalt. Alors, c'était la preuve qu'il s'agissait en fait d'atomes isolés de cobalt dispersés à la surface, " a déclaré Frenkel.
"Ces données affinent également les dispositions structurelles possibles, qui fournit des informations aux théoriciens pour évaluer et comprendre pleinement les réactions, " ajouta Frenkel.
Bien que la science décrite dans le document ne soit pas encore utilisée dans la pratique, les possibilités d'applications sont nombreuses, dit Frenkel. À l'avenir, de tels catalyseurs à site unique pourraient être utilisés dans des zones à grande échelle avec un ensoleillement abondant pour décomposer l'excès de CO