Ces chiffres du nouveau Avancées scientifiques Cet article montre comment les anticorps se lient pour verrouiller la protéine circumsporozoïte du paludisme dans une conformation en spirale. Crédit :Wilson/Ward labs, Recherche Scripps
Les scientifiques qui étudient la façon dont le système immunitaire humain se défend contre le paludisme ont découvert un phénomène rare :des anticorps travaillant ensemble pour se lier à un point vulnérable du parasite.
La nouvelle recherche, publié récemment dans Avancées scientifiques , montre que les anticorps travaillant ensemble peuvent entraîner une protéine sur la surface cellulaire du parasite le verrouillant dans une conformation en spirale, comme un large tire-bouchon, empêcher le parasite de commencer son cycle de vie dans l'hôte humain et, Par conséquent, protéger contre les infections.
"Les premières images étaient assez remarquables et nous ont donné nos premiers aperçus sur la façon dont le peptide de surface étendue pouvait être reconnu, " dit Andrew Ward, Doctorat., un professeur de Scripps Research et auteur correspondant de l'étude. "CryoEM était particulièrement bien adapté pour résoudre cette structure et ouvre la porte à d'autres comme celle-ci. Pour aider à fabriquer un vaccin efficace, nous devons comprendre le bon mode de reconnaissance de ce peptide typiquement flexible par les anticorps."
L'étude fait partie d'un effort international visant à améliorer le vaccin antipaludique le plus avancé, appelé RTS, S, qui a fait l'objet d'essais cliniques. Le vaccin candidat est actuellement efficace d'environ 25 à 50 pour cent selon le schéma vaccinal, mais avec des centaines de milliers de personnes qui meurent encore du paludisme chaque année, les chercheurs cherchent des moyens de reconcevoir ou de reformuler les vaccins.
Pour faire ça, des scientifiques du campus californien de Scripps Research étudient les anticorps que le corps humain produit lorsqu'il reçoit le RTS, Vaccin S. Ils sont particulièrement intéressés par les anticorps qui se lient au parasite du paludisme au début de son cycle de vie et protègent contre l'infection, et si ces anticorps imitent ceux produits par une infection naturelle.
"Si vous pouvez bloquer cette première étape chez l'homme, vous pouvez bloquer tout le cycle de vie du parasite, " dit Jonathan Torres, assistant de recherche à Scripps Research et co-premier auteur de l'étude.
Ces anticorps protecteurs sont connus pour se lier à la protéine circumsporozoïte du paludisme, la protéine la plus abondante à la surface du parasite, mais personne n'a été en mesure d'avoir un aperçu clair de la façon dont ils le font. Comprendre comment ces anticorps font leur travail peut aider à orienter la conception de vaccins antipaludiques qui peuvent déclencher la même réponse en anticorps. Cette technique est appelée conception rationnelle de vaccins.
En utilisant une technique d'imagerie appelée cryomicroscopie électronique (EM), les scientifiques ont obtenu les premières images d'un anticorps lié à la protéine circumsporozoïte. Co-premier auteur de l'étude David Oyen, Doctorat., associé de recherche chez Scripps Research, dit qu'il a été surpris par ce que les structures cryo-EM ont révélé.
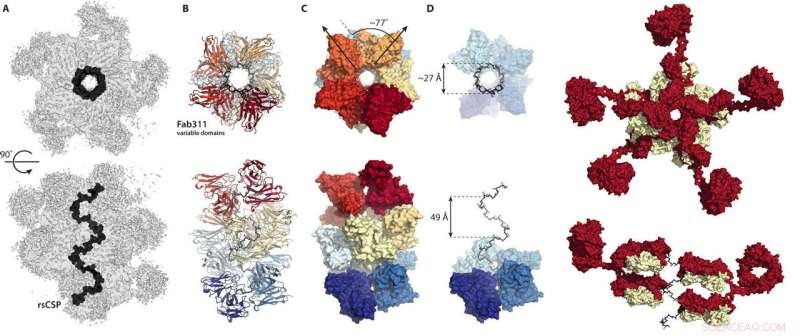
La forme de la protéine a toujours été difficile à imaginer en raison d'une grande région de faible complexité au centre de la protéine constituée de plusieurs répétitions de quatre acides aminés qui donnent à la protéine une disquette, forme souple. Oyen pensait que les anticorps se lieraient à cette zone "comme des perles sur une ficelle".
Au lieu, les structures cryo-EM ont montré la région de répétition de la protéine circumsporozoïte enfermée dans une structure en spirale, avec 11 fragments d'anticorps (Fab311) dépassant de leurs sites de liaison, qui se compose de deux répétitions, et rayonnant tangentiellement à partir de la spirale allongée.
Plus surprenant encore, la stabilité en spirale est conférée par les contacts entre les anticorps. "C'est comme s'ils liaient les bras entre eux pour former un complexe plus fort, " dit Oyen. A la connaissance des scientifiques, c'est la première fois que la structure tridimensionnelle de la région répétée de la protéine circumsporozoïte est élucidée, grâce aux contacts stabilisants inter-anticorps. "Ce n'est qu'en raison des multiples répétitions de séquences sur cette protéine que ces contacts inter-anticorps sont possibles, " dit Oyen.
"Cette structure est très excitante - la séquence répétée de quatre acides aminés en elle-même avait été expérimentalement trouvée il y a de nombreuses années pour former un tour bêta et les multiples répétitions prédites pour des structures de type hélicoïdal, mais cette structure est très différente de celles-ci car c'est un tire-bouchon très large et très allongé comme un grand escalier en colimaçon, " dit Ian Wilson, DPhil, Professeur Hansen de biologie structurale à Scripps Research, président du Département de biologie structurelle et computationnelle intégrative et co-auteur de l'étude.
L'anticorps montré avec la protéine circumsporozoïte dans cette étude n'est que l'un des nombreux que l'équipe prévoit d'imager avec cryo-EM. Ils espèrent comparer les structures pour voir si les anticorps protecteurs partagent des caractéristiques. Certains pourraient avoir des contacts inter-anticorps, certains pourraient pas.
"Nous voulons rendre le vaccin contre le paludisme aussi efficace que possible, " dit Oyen. " Et nous espérons pouvoir utiliser ces structures cryo-EM pour concevoir des candidats vaccins nouveaux ou améliorés. "