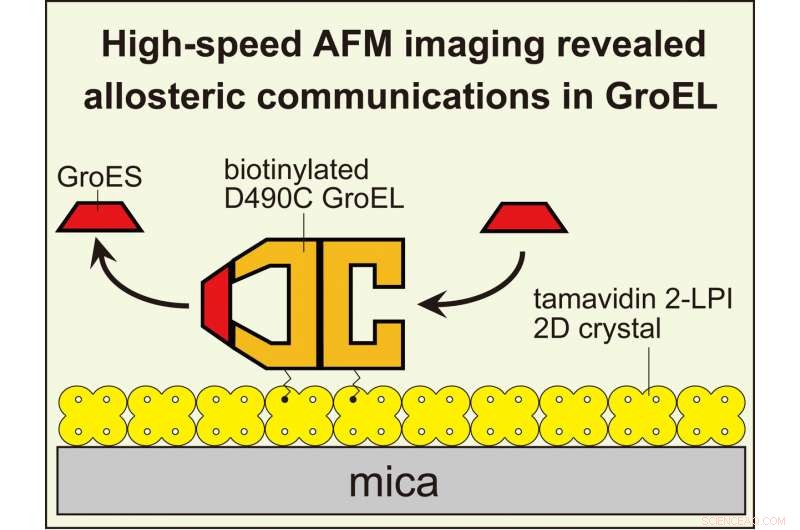
L'imagerie HS-AFM a révélé des communications allostériques inter-anneaux dans GroEL régissant sa réaction de chaperonine. Pour visualiser les interactions dynamiques GroEL-GroES avec l'AFM haute vitesse, GroEL biotinylé à ses domaines équatoriaux a été attaché au cristal bidimensionnel de tamavidine 2-LPI directement formé sur la surface du mica. Crédit :Université de Kanazawa
Les protéines doivent se replier d'une manière spécifique pour fonctionner. Ceci est souvent assisté par des chaperons moléculaires, de petites protéines dont le travail est d'aider les autres à se plier à la bonne forme. Maintenant, Des chercheurs japonais ont découvert que pour un chaperon moléculaire au moins, il y a plus dans le processus qu'on ne le soupçonnait.
Dans un journal en Transactions philosophiques de la Royal Society , le groupe dirigé par Kanazawa axé sur GroEL, ce qui est vital pour le repliement des protéines chez les bactéries. Les grandes lignes sont comprises :GroEL capture une protéine cible dépliée (le substrat) à l'intérieur d'une cavité, où il peut se plier correctement sans s'agréger. Cependant, les détails mécaniques sont difficiles à démêler avec les méthodes d'ensemble traditionnelles. Dans la nouvelle étude, La microscopie à force atomique à grande vitesse (HS-AFM) a été utilisée pour visualiser les événements plus directement.
GroEL est une molécule cylindrique, composé de deux anneaux empilés dos à dos. Un partenaire clé dans sa fonction est GroES, une "co-chaperonine" en forme d'anneau qui se lie à chaque extrémité de GroEL comme un couvercle en forme de dôme. Ce n'est que lorsque GroEL est coiffé par GroES qu'il peut piéger la protéine substrat. Puis, lorsque le pliage est terminé, GroES se dissocie de GroEL, et le substrat plié est libéré.
Là où cela devient flou, c'est la façon dont les deux anneaux à chaque extrémité de GroEL coopèrent. Les anneaux sont identiques, et les deux peuvent être plafonnés par GroES. Lorsqu'une seule extrémité est coiffée, le complexe résultant est appelé une "balle", en raison de son aspect pointu. Pendant ce temps, la forme avec les deux extrémités coiffées est surnommée un "football", car sa forme ovale symétrique ressemble à une boule de gril.

Événements d'association et de dissociation GroES capturés par l'imagerie HS-AFM. Bien que la réaction se déroule principalement de manière alternative comme B? ? F ? B? ? F (B et F représentent des complexes de balles et de football, respectivement, et les flèches verticales indiquent la polarité des complexes de balles), il se produit parfois de différentes manières. Crédit :Université de Kanazawa
"Dans un modèle conventionnel, le cycle de coiffage, repliement des protéines, et le décapsulage alterne entre chaque anneau, " explique le co-auteur de l'étude Daisuke Noshiro. " Le coiffage d'un anneau de GroEL (qui a une stéréochimie cis) empêche le coiffage simultané à l'autre extrémité (trans). Une telle communication intramoléculaire est connue sous le nom d'allostère. la balle à capuchon simple est la forme active de GroEL, et le football n'est qu'un intermédiaire de courte durée entre les cycles.
D'autres découvertes, bien que, ont fait allusion à une plus grande complexité, ce qui a été mis en évidence par cette nouvelle étude. Selon le type de substrat, GroEL est apparu comme un ballon de football, plutôt qu'une balle, jusqu'à 67 % du temps, impliquant une rupture de la régulation allostérique négative. C'était le plus courant lorsque le substrat était une protéine dépliable ou qu'il n'y avait pas de substrat du tout, mais même avec des substrats pliables, les complexes de football abondaient.
Plus inattendu, le cycle s'est produit par deux voies différentes. Dans le type I prédominant, lorsque l'anneau actif de GroEL termine sa tâche et que l'autre extrémité prend le relais, les deux anneaux échangent également des conformations cis et trans. Cependant, environ 25% du temps (dans le type II), les conformations ne sont pas échangées, perturber la circulaire, rythme alterné de Type I. Néanmoins, le repliement des protéines se produit toujours. Les ballons de football sont répandus dans les deux cas.
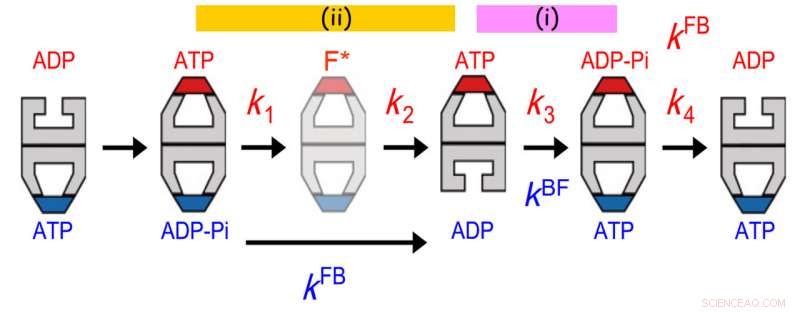
Communications allostériques entre deux anneaux de GroEL. La distribution de la durée de vie du GroES lié était mieux adaptée à un modèle de réaction séquentiel en quatre étapes avec quatre constantes de vitesse, k1, k2, k3 et k4. La valeur de k3 concordait avec celle du taux de transition balle-football (kBF) dans l'anneau opposé. De plus, la valeur de 1/k1 + 1/k2 concordait avec celle de 1/kFB (kFB, le taux de transition football-balle dans l'anneau opposé). L'ancien accord indique que l'hydrolyse de l'ATP en ADP-Pi sur un anneau agit comme un garde-temps pour la libération d'ADP de l'anneau trans opposé, assurer la libération de la protéine substrat de l'anneau trans avant qu'il ne soit coiffé avec GroES. Ce dernier accord indique qu'un événement survenant dans la deuxième étape après la liaison de l'ATP déclenche la libération de Pi de l'anneau opposé. Crédit :Université de Kanazawa
"La structure du football est si abondante, il doit jouer un rôle plus actif qu'on ne le pensait, " explique l'auteur correspondant Toshio Ando. " Ce mécanisme complexe est important, parce que les chaperonines sont une classe naturelle de machines moléculaires. Les subtilités de GroEL peuvent nous aider à comprendre plus généralement le rôle de l'allostère dans les machines moléculaires."