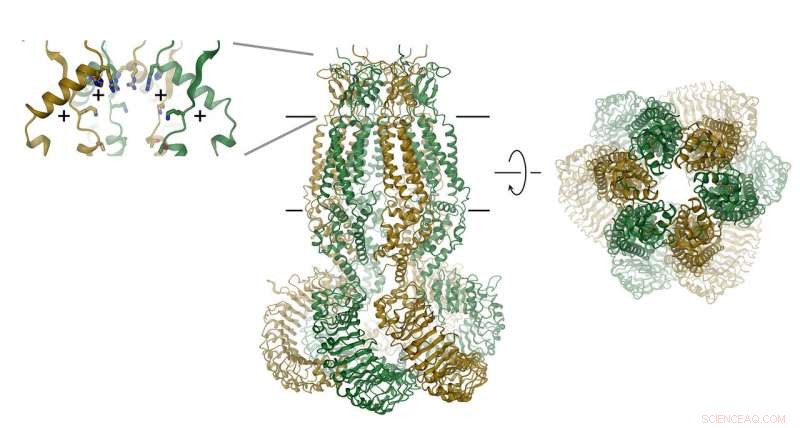
La protéine, qui se compose de six sous-unités, est représenté par un ruban. La position de la membrane est indiquée par des lignes. Le filtre de sélectivité est représenté en encart (à droite). Les positions des acides aminés chargés positivement sont indiquées par (+). Crédit :Raimund Dutzler, UZH
Des biochimistes de l'Université de Zurich ont déterminé la structure détaillée d'un canal chlorure à volume régulé. Cette valve cellulaire est activée en réponse au gonflement pour empêcher l'éclatement de la cellule. La protéine joue également un rôle important dans l'absorption de produits chimiothérapeutiques et la libération de neurotransmetteurs après un accident vasculaire cérébral. La régulation contrôlée de son activité ouvre ainsi une stratégie prometteuse pour de nouvelles thérapies.
Les cellules humaines sont entourées de membranes et sont en équilibre osmotique avec leur environnement. Si la concentration de molécules de soluté (osmolarité) dans le liquide entourant les cellules diminue, les cellules commencent à gonfler; dans des cas extrêmes, cela peut entraîner l'éclatement des cellules. Pour éviter cela, les cellules activent les canaux chlorure à volume régulé (VRAC) de la famille des protéines LRRC8. Si le volume de la cellule augmente en raison de l'arrivée d'eau, ces valves cellulaires s'ouvrent pour laisser s'écouler les ions chlorure chargés négativement et les osmolytes non chargés, remettre la cellule dans son état d'origine.
Bien que découvert il y a seulement cinq ans, des propriétés importantes de ces valves cellulaires ont déjà été décrites. Par exemple, Il est connu que, outre leur rôle dans la régulation du volume, Les VRAC jouent un rôle important dans l'absorption des médicaments utilisés dans le traitement du cancer et ils sont responsables de la libération incontrôlée de neurotransmetteurs après un AVC. Malgré ces avancées, la composition moléculaire des VRAC et la base de leur sélectivité sont restées insaisissables. Des chercheurs du Département de biochimie de l'Université de Zurich ont maintenant comblé cette lacune dans notre compréhension. En utilisant la cryo-microscopie électronique et la cristallographie aux rayons X, l'équipe dirigée par le professeur Raimund Dutzler a déterminé la structure moléculaire détaillée d'un VRAC. En outre, les chercheurs ont analysé les propriétés fonctionnelles de la protéine par des techniques électrophysiologiques.
Les VRAC se composent de six sous-unités, qui sont disposés autour d'un axe qui définit le pore de perméation ionique. La protéine, qui est situé dans la membrane, contient un petit domaine extracellulaire et un grand domaine intracellulaire. Ce dernier joue probablement un rôle important dans l'activation des canaux. Le domaine extracellulaire resserre le canal et fonctionne comme un filtre de sélectivité. "Les résidus positifs dans ce filtre attirent les ions chlorure chargés négativement et permettent leur perméation tout en empêchant les plus grosses molécules d'entrer dans la cellule, " explique Raimund Dutzler.
Avec leur travail, les scientifiques de l'UZH ont jeté les bases d'une meilleure compréhension des mécanismes moléculaires qui sous-tendent le contrôle du volume cellulaire. "Ces connaissances fournissent une base précieuse pour le développement de nouveaux médicaments potentiels, " dit Dutzler. En cas d'ischémie cérébrale ou d'accident vasculaire cérébral, les astrocytes dans le cerveau gonflent. La sortie incontrôlée résultante du neurotransmetteur glutamate, qui est médiatisé par les VRAC, a des conséquences néfastes pour les personnes touchées. De tels cas pourraient bénéficier du développement de bloqueurs spécifiques. Une autre application potentielle concerne le rôle des VRAC dans le traitement du cancer :une activation spécifique aux cellules des VRAC pourrait améliorer l'absorption de produits thérapeutiques dans les cellules cancéreuses.