La conception d'un artiste de la puissance de la conception informatique pour explorer et éclairer les peptides structurés à travers le vaste paysage énergétique. Crédit :Vikram Mulligan/Institut de conception de protéines de l'Université de Washington
De nouvelles stratégies de calcul rapportées cette semaine dans Science pourrait aider à réaliser la promesse des médicaments à base de peptides. Les peptides sont similaires aux molécules de protéines, mais diffèrent par leur plus petite taille, structure et fonctions.
Les peptides macrocycliques ont suscité l'intérêt de l'industrie pharmaceutique, car ils ont certaines propriétés physiques et chimiques qui pourraient devenir la base d'une nouvelle génération de médicaments.
Les petits peptides ont les avantages des médicaments à petites molécules, comme l'aspirine, et de grandes thérapies par anticorps, comme le rituximab, avec moins d'inconvénients. Ils sont stables comme de petites molécules et puissants et sélectifs comme des anticorps.
La cyclosporine est un exemple de réussite d'un médicament peptidique macrocyclique un immunosuppresseur pour les greffes d'organes et certaines maladies auto-immunes.
Avant les travaux décrits dans le Science papier, il n'y avait aucun moyen de concevoir systématiquement des macrocycles peptidiques ordonnés comme la cyclosporine.
Peptides naturels qui pourraient servir de points de départ fiables, ou des échafaudages, sont peu nombreux. Tout aussi frustrant, c'est qu'ils ne fonctionnent souvent pas comme prévu lorsqu'ils sont réutilisés. Au lieu, les chercheurs avaient eu recours au dépistage de grandes, des bibliothèques de composés générées aléatoirement dans l'espoir de trouver ce dont ils avaient besoin.
Les méthodes abordées dans le rapport, "La conception informatique complète de macrocycles peptidiques ordonnés" résout maintenant ces problèmes.
Cette illustration conceptuelle montre comment les hétéropolymères peptidiques peuvent être programmés à partir de composants plus petits pour explorer un paysage énergétique diversifié. Crédit :Ahmad Hosseinzadeh et Khosro Khosravi
Les auteurs principaux sont Parisa Hossienzadeh, Gaurav Bhardwaj et Vikram Mulligan, du Département de biochimie de l'École de médecine de l'Université de Washington et de l'UW Institute of Protein Design. L'auteur principal est David Baker, professeur de biochimie et directeur de l'institut. Baker est également un chercheur du Howard Hughes Medical Institute.
« Dans notre journal, " les chercheurs ont noté, "nous décrivons des stratégies de calcul pour concevoir des peptides qui adoptent des formes diverses avec une très grande précision et pour fournir une couverture complète des structures qui peuvent être formées par de courts peptides."
Ils ont souligné les avantages de cette nouvelle approche informatique :
D'abord, ils ont pu concevoir et compiler une bibliothèque de nombreux nouveaux échafaudages peptidiques stables pouvant fournir les plates-formes de base pour l'architecture des candidats-médicaments. Leurs méthodes peuvent également être utilisées pour concevoir des peptides personnalisés supplémentaires avec des formes arbitraires à la demande.
"Nous avons échantillonné le paysage diversifié des formes que les peptides peuvent former, comme guide pour la conception de la prochaine génération de médicaments, ", ont déclaré les chercheurs.
La clé du contrôle de la géométrie et de la chimie des molécules était la conception de peptides avec des acides aminés naturels, appelés acides aminés L, et leurs miroirs opposés contenant des acides aminés D. (Le L et le D représentent les mots latins pour tourner à gauche ou à droite, car certaines structures moléculaires peuvent être gauchères ou droites ou chirales).
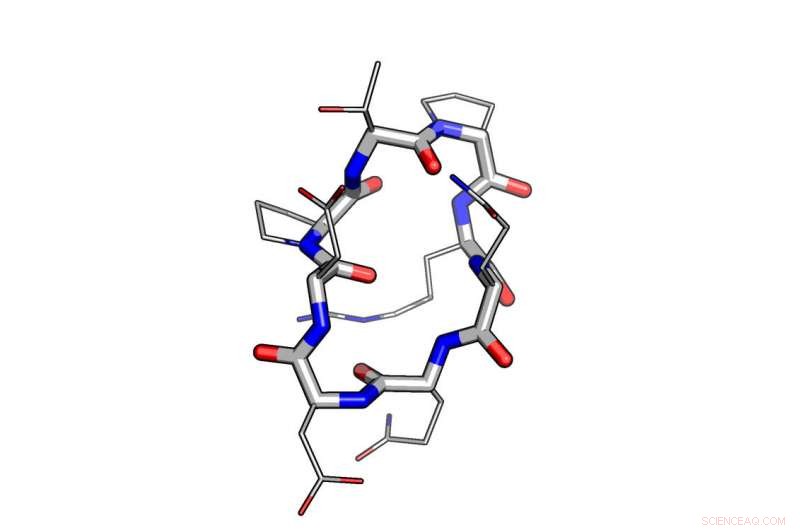
Un exemple de l'utilisation de la conception informatique dans la modélisation d'un peptide. Crédit : Institut de conception de protéines de l'Université de Washington
Les acides aminés D ont amélioré les propriétés pharmacologiques en augmentant la résistance aux enzymes naturelles qui décomposent les peptides. L'inclusion d'acides aminés D dans les conceptions permet également une gamme plus diversifiée de formes.
La conception de peptides nécessite une puissance informatique intensive, entraînant des calculs coûteux. Les chercheurs ont crédité un groupe de scientifiques citoyens et de bénévoles qui ont fait don de leurs minutes de smartphone cellulaire et de leur temps d'ordinateur. Le supercalculateur Hyak de l'Université de Washington a également exécuté certains des programmes.
Les chercheurs ont indiqué les orientations futures de leurs approches de conception informatique des peptides. Ils espèrent concevoir des peptides capables de pénétrer les membranes cellulaires et d'entrer dans les cellules vivantes.
Sous d'autres aspects, ils prévoient d'ajouter de nouvelles fonctionnalités aux structures peptidiques en stabilisant les motifs de liaison aux interfaces protéine-protéine pour les études scientifiques fondamentales. Pour les applications cliniques, ils prévoient d'utiliser leurs méthodes et leurs échafaudages pour développer des médicaments à base de peptides.