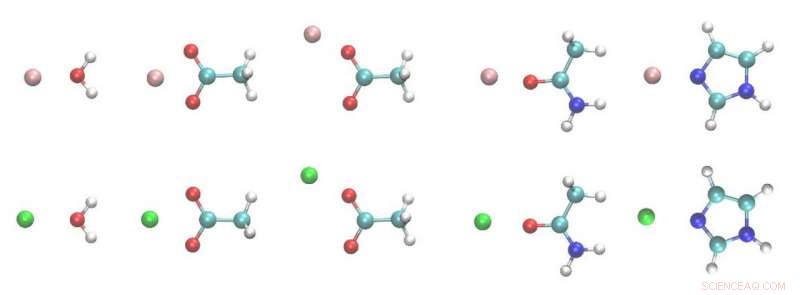
Structures des dimères ion métallique-ligand. Blanche, cyan, bleu, rouge, les sphères roses et vertes sont H, C, N, , Atomes Mg et Ca. Crédits :Zhifeng Jing, Rui Qi, Chengwen Liu et Pengyu Ren
Contractions musculaires, digestion du lactose, circulation sanguine - qu'est-ce qui pourrait éventuellement relier ces fonctions corporelles ? Vous serez peut-être surpris d'apprendre que tous ces processus et bien d'autres sont entraînés par des ions métalliques.
Sodium (Na+), potassium (K+), le calcium (Ca2+) et le magnésium (Mg2+) pourraient être des noms familiers, mais ils sont également essentiels au fonctionnement des cellules humaines. La combinaison de ces ions avec des protéines corporelles crée des complexes indispensables à notre existence continue.
L'importance des interactions entre les protéines et les ions métalliques est bien comprise, mais les interactions mécaniques entre les deux sont encore loin d'être complètes.
Zhifeng Jin, Rui Qi, Chengwen Liu et Pengyu Ren, professeurs du département de génie biomédical de l'Université du Texas à Austin, travaillent à décrire quantitativement les interactions protéine-ion en utilisant ce qu'on appelle un champ de force énergétique optimisé multipolaire atomique pour les applications biomoléculaires (AMOEBA). Ils décrivent leur travail dans le Journal de physique chimique .
La technologie AMOEBA a été développée par Ren et Jay Ponder, de l'Université du Texas à Austin et de l'Université Washington à St. Louis. Il utilise un modèle multipolaire atomique polarisable pour calculer l'énergie potentielle d'un système. Le modèle AMOEBA vise à remédier aux insuffisances connues de la technologie actuelle des champs de force pour modéliser avec précision les interactions entre les ions et les protéines.
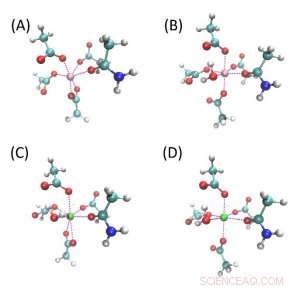
Structures de composés modèles pour les poches de liaison ionique. (A) et (B) sont des poches de liaison au Mg tandis que (C) et (D) sont des poches de liaison au Ca. Blanche, cyan, bleu, rouge, les sphères roses et vertes sont H, C, N, , Atomes Mg et Ca. Toutes ces quatre structures sont constituées de quatre molécules d'acétate et d'un acétamide, et (B-D) ont une molécule d'eau supplémentaire. (A) et (C) ont chacun un acétate bidenté, et tous les autres acétates se lient à l'ion métallique avec un atome d'oxygène. Ces quatre modèles sont notés Mg-Bi, Mg-Mono, Ca-Bi et Ca-Mono respectivement. Crédits :Zhifeng Jing, Rui Qi, Chengwen Liu et Pengyu Ren
"Le manque de compréhension détaillée est principalement dû au manque de modèles précis et pourtant efficaces en termes de calcul pour traiter les ions métalliques, ", a déclaré Ren. "Nous visons à appliquer des méthodes de mécanique quantique de haut niveau et des simulations avancées de champ de force pour comprendre la nature des interactions entre les ions métalliques et les protéines."
AMOEBA améliore les simulations biomoléculaires classiques, dont les modèles représentent l'interaction intermoléculaire en utilisant la somme de deux forces, selon Ren :l'interaction de van der Waals et l'interaction de Coulomb entre charges ponctuelles.
"Cette représentation est suffisamment simple pour être calculable, et il a été largement utilisé au cours des dernières décennies, " dit-il. " Cependant, les ions métalliques peuvent conduire à de forts effets de polarisation et de transfert de charge, qui manquent à ces modèles classiques. Nous pensons que ces effets jouent [a] un rôle critique dans l'interaction spécifique ion-protéine."
Ren et ses collègues ont étudié spécifiquement l'interaction entre Mg2+/Ca2+ et les acides aminés. Le magnésium et le calcium sont parmi les ions les plus abondants dans les métalloprotéines, protéines avec un cofacteur d'ions métalliques. Les deux sont sélectivement liés à des acides aminés spécifiques, ce qui en fait des molécules cibles intéressantes. La réponse à plusieurs corps, l'induction mutuelle entre les ions et leurs résidus environnants dans les poches de liaison aux protéines, a également un impact sur l'affinité de liaison de ces ions et peut être capturé par le modèle AMOEBA.
"La différence entre la réponse à plusieurs corps au Ca2+ par rapport au Mg2+ dans la poche de fixation est substantielle, " a déclaré Ren. " On savait que la polarisation et le transfert de charge sont importants dans les complexes protéine-ion, mais pour la reliure compétitive, beaucoup ont soupçonné que ces effets pourraient s'annuler."
Le modèle AMOEBA et les avancées des champs de force, y compris les applications de ces résultats, Ren a souligné, sont pertinents dans de nombreuses maladies, y compris le cancer et les troubles neurodégénératifs. La connaissance des interactions protéine-ion peut fournir une compréhension fondamentale pour l'avancement des recherches médicales connexes.