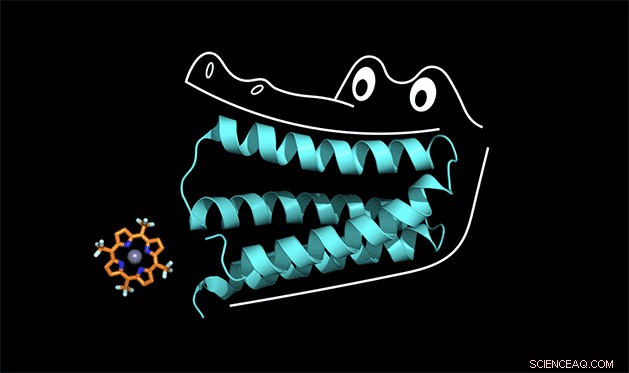
La protéine synthétique serre la porphyrine comme les mâchoires d'un alligator. Crédit :Nicolas Polizzi
Les protéines ont le pouvoir de stimuler les réactions biochimiques à l'intérieur du corps.
Sans l'aide de types de protéines appelées enzymes, la réaction qui construit l'ADN pourrait prendre plus de 130, 000 ans à compléter. Les enzymes réduisent ce temps à quelques millisecondes.
Pour accélérer les réactions chimiques, de nombreuses protéines s'associent à des molécules ou des métaux plus petits appelés cofacteurs. Les chimistes aimeraient concevoir des protéines qui se lient à des cofacteurs non biologiques afin d'accélérer des réactions chimiques que l'on ne trouve pas dans la nature. Mais d'abord, ils doivent trouver comment créer des protéines artificielles qui se fixent aux nouveaux cofacteurs exactement de la bonne manière, et ce n'est pas une mince affaire.
Une équipe de chimistes de Duke et UC San Francisco est la première à résoudre ce casse-tête de conception de protéines. L'équipe a créé une protéine synthétique qui lie étroitement un catalyseur non biologique, un type de molécule appelée porphyrine qui est capable de voler des électrons à d'autres molécules lorsqu'elle absorbe la lumière.
« Pouvoir combiner des catalyseurs artificiels avec des protéines serait vraiment important dans le domaine de la chimie, car vous pourriez alors combiner la puissance d'une enzyme avec celle d'une réaction qui ne se trouve pas dans la nature, " a déclaré l'ancien étudiant diplômé de Duke Nicholas Polizzi, qui est maintenant chercheur postdoctoral dans le laboratoire de William DeGrado à l'UCSF.
« Nous avons pu déterminer les critères de conception nécessaires pour placer cette porphyrine dans une protéine avec une très grande précision, ", a déclaré Polizzi. "C'était un tremplin vraiment important pour pouvoir concevoir de nouvelles combinaisons protéine-cofacteur jamais vues dans la nature."
Les protéines sont constituées de chaînes de centaines ou de milliers d'acides aminés plus petits qui se tordent et s'enroulent en des formes complexes en 3D qui peuvent s'imbriquer avec d'autres molécules comme les pièces d'un puzzle. Pour catalyser des réactions chimiques, les combinaisons protéine-cofacteur contiennent deux molécules ou plus dans des poches de forme précise qui maintiennent les molécules dans les bonnes positions, et fournir le bon environnement, pour qu'une réaction chimique se produise.
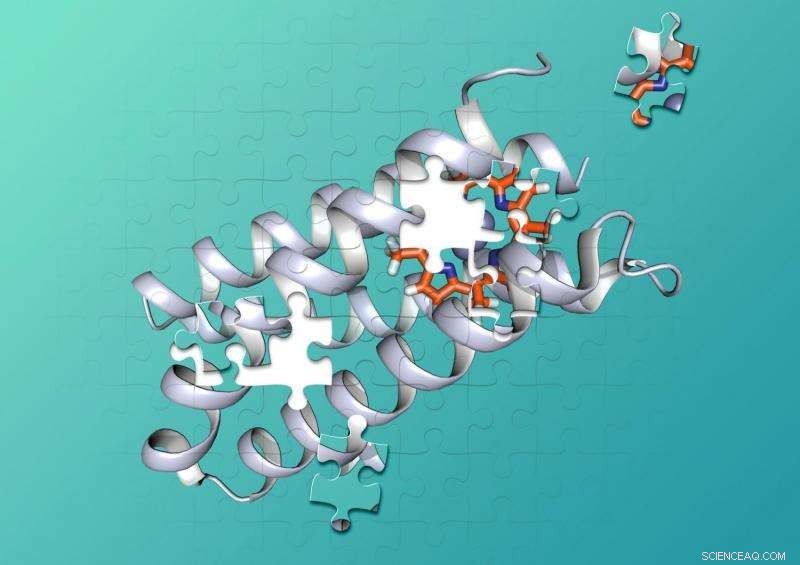
Les chimistes de Duke et de l'UCSF ont conçu une protéine synthétique qui lie étroitement une molécule non biologique. Crédit :Nicolas Polizzi
Des millions d'années d'évolution ont créé des protéines qui se replient dans des formes qui adhèrent étroitement à des cofacteurs spécifiques et fournissent les environnements parfaits pour catalyser les réactions chimiques.
Depuis plus de 25 ans, les chimistes ont utilisé ce qu'ils savent sur le repliement des protéines pour concevoir des séquences d'acides aminés synthétiques qui se transforment en formes utiles. Mais si loin, ils ont été incapables de concevoir une protéine qui lie un cofacteur non biologique avec la précision nécessaire pour alimenter de nouvelles réactions chimiques complexes.
Polizzi a déclaré que cela pouvait être dû au fait que ces conceptions se concentraient principalement sur le "site de liaison" où les cofacteurs et les molécules réactives s'insèrent dans la protéine, tout en ignorant le reste de la structure. "Ce que j'ai fait différemment, c'est que j'ai considéré essentiellement tout l'intérieur de la protéine comme le site de liaison de la porphyrine, par opposition à quelques acides aminés qui touchent la porphyrine, ", a déclaré Polizzi.
Pour comprendre comment cela fonctionne, vous pouvez penser à la protéine comme la bouche d'un alligator, dit Michel Thérien, William R. Kenan Jr. Professeur de chimie à Duke. La protéine s'accroche à un cofacteur de la même manière qu'un alligator utilise ses dents de devant pour avaler le dîner. Mais pour que les dents de devant aient une bonne adhérence, la mâchoire et les dents du fond doivent également être conçues correctement.
"Le nouveau concept ici est que la région non liante de la protéine est maintenue dans une forme qui permet à la région liante de fonctionner, " dit Thérien.
"Nous avons appelé la protéine 'gator' dans le laboratoire, ", a déclaré Polizzi.
Les mâchoires de la protéine gator serrent en fait si fort sur le cofacteur porphyrine que toute la structure est trop rigide pour catalyser une réaction, dit Polizzi. Mais avec quelques ajustements pour assouplir la structure, il pense qu'il peut le faire fonctionner.
« Dans cette réaction, Souvent, vous avez besoin d'un peu de marge de manœuvre dans la protéine pour qu'elle bouge. Et il n'y avait pas de marge de manœuvre dans nos protéines, tout va trop bien, ", a déclaré Polizzi.