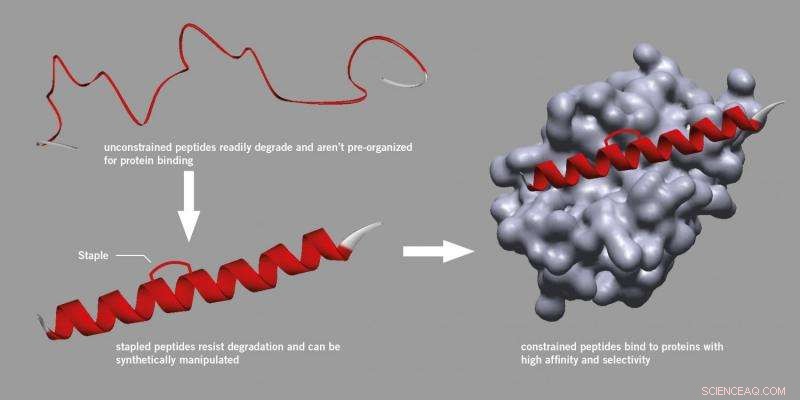
Agrafage peptidique. Crédit :Université de Leeds
Des scientifiques britanniques ont créé une nouvelle méthode pour structurer les peptides, ce qui, selon eux, sera moins cher et rendra le processus d'utilisation de peptides agrafés dans la découverte de médicaments beaucoup plus largement disponible.
La méthode développée par l'équipe de neuf personnes de l'Université de Leeds, et en exploitant la chimie de synthèse développée à l'University College de Londres, est plus polyvalent, moins cher, totalement réversible et conduit à des peptides dont les propriétés pharmacocinétiques, comme la solubilité pourrait être facilement ajustée, selon le professeur Andrew Wilson, qui a dirigé l'étude.
L'approche pourrait permettre à des scientifiques qualifiés de contraindre un peptide, le livrer à une cellule particulière puis le décontraindre, l'empêchant de quitter à nouveau la cellule.
Rendre les peptides plus utiles
Les scientifiques et les fabricants de médicaments considèrent généralement les peptides avec scepticisme, estimant qu'ils sont trop peu fiables pour être utilisés comme médicaments car ils se dégradent facilement dans les cellules et sont difficiles à manipuler.
Cependant, des recherches initiées à l'Université de Harvard ont trouvé une méthode pour introduire un corset qui pourrait être attaché à un peptide, renforcer sa structure active et la rendre plus stable et moins susceptible de se dégrader.
Ce processus, connu sous le nom de « agrafage » utilise une méthode de synthèse spécifique et est maintenant devenu une approche reconnue dans la découverte de médicaments peptidiques, entraînant même la création de nouvelles entreprises en démarrage. Les peptides agrafés ne se décomposent pas, se lient mieux aux protéines et ont des propriétés pharmacocinétiques améliorées telles que l'absorption cellulaire.
Interactions protéine-protéine
Un changement généralisé de perspective sur les peptides est apparu en raison de la nécessité pour l'industrie pharmaceutique de développer des médicaments qui agissent sur les interactions protéine-protéine, contrairement au mode de reconnaissance traditionnel « verrou et clé » exploité par la plupart des médicaments actuels. Les petites molécules qui agissent sur les interactions protéine-protéine doivent couvrir une surface plus grande et moins convexe.
Professeur Wilson, dont l'équipe travaille sur ce problème, a déclaré que « les scientifiques ont eu un succès limité dans le développement de petites molécules traditionnelles qui agissent sur les interactions protéine-protéine, et développer des peptides de cette manière est une alternative intéressante."
Il a ajouté :« Les niveaux de contact beaucoup plus élevés entre le peptide et la protéine peuvent être exploités pour obtenir une affinité et une sélectivité plus élevées, nous sommes donc enthousiasmés par cette approche alternative de l'agrafage."
Acides aminés naturels
L'équipe de l'Université de Leeds a porté le principe de l'agrafage peptidique à un nouveau niveau. La méthode est basée sur la réaction de deux thiols dans une séquence peptidique avec un réactif dibromomaléimide.
Lorsque les deux thiols sont correctement placés dans la séquence peptidique, la réaction entraîne le verrouillage de la structure dans une forme hélicoïdale spécifique et bioactive qui est plus stable.
La méthode fonctionne sur des séquences peptidiques contenant les acides aminés naturels et communs cystéine ou homocystéine. Cela permettra d'accéder à des peptides appropriés via des méthodes chimiques et biologiques de routine.
Professeur Wilson, de l'École de chimie de l'Université de Leeds et du Centre de biologie moléculaire structurelle d'Astbury a déclaré :« Notre approche de l'agrafage des protéines est plus flexible, potentiellement moins cher, et devrait être plus facile à utiliser en biologie chimique et en découverte de médicaments.
Le document de recherche complet Double Quick, Double Click Reversible Peptide 'Stapling' est publié dans la Royal Society of Chemistry's Sciences chimiques journal le 31 mai 2017.
Dr Michael Webb, Professeur agrégé de chimie organique à l'Université de Leeds, a déclaré :« Nous avons développé une nouvelle méthode pour introduire rapidement une contrainte fonctionnelle dans deux peptides modèles, ce qui améliore une gamme de propriétés biophysiques et biochimiques. Contrairement à d'autres méthodes, elle peut également être inversée.
« Cette approche peut être réalisée en utilisant des acides aminés naturellement disponibles, apportant potentiellement l'agrafage peptidique à une communauté plus large.
"La capacité d'inverser la contrainte peut permettre la livraison de réactifs à base de peptides dans la cellule où ils peuvent être sans contrainte et moins faciles à transporter."