L'ingénierie cellulaire peut être un outil puissant pour synthétiser des cristaux de protéines fonctionnels dotés de propriétés catalytiques prometteuses, montrent des chercheurs de Tokyo Tech. En utilisant des bactéries génétiquement modifiées comme plateforme de synthèse respectueuse de l’environnement, les chercheurs ont produit des catalyseurs solides hybrides pour la photosynthèse artificielle. Ces catalyseurs présentent une activité, une stabilité et une durabilité élevées, soulignant le potentiel de l'approche innovante proposée.
Les cristaux de protéines, comme les cristaux ordinaires, sont des structures moléculaires bien ordonnées dotées de propriétés diverses et d’un énorme potentiel de personnalisation. Ils peuvent s'assembler naturellement à partir de matériaux présents dans les cellules, ce qui non seulement réduit considérablement les coûts de synthèse, mais diminue également leur impact environnemental.
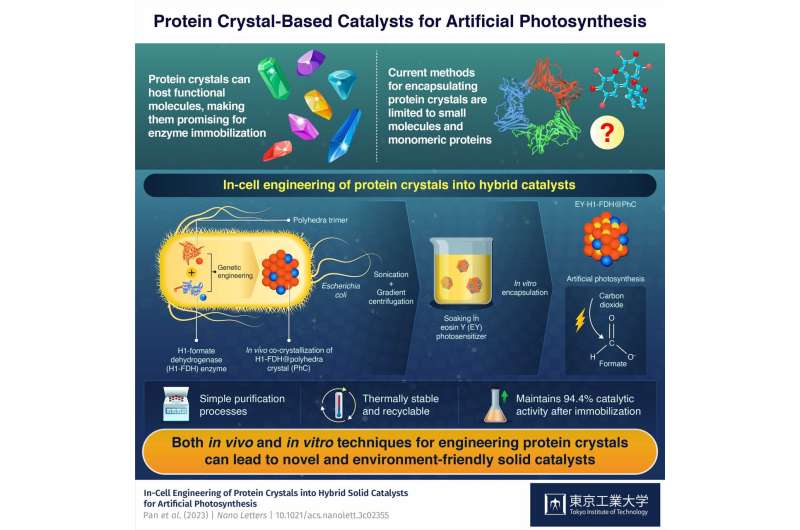
Bien que les cristaux de protéines soient prometteurs en tant que catalyseurs car ils peuvent héberger diverses molécules fonctionnelles, les techniques actuelles ne permettent que la fixation de petites molécules et de protéines simples. Il est donc impératif de trouver des moyens de produire des cristaux de protéines contenant à la fois des enzymes naturelles et des molécules fonctionnelles synthétiques afin d'exploiter tout leur potentiel d'immobilisation des enzymes.
Dans ce contexte, une équipe de chercheurs de l'Institut de technologie de Tokyo (Tokyo Tech) dirigée par le professeur Takafumi Ueno a développé une stratégie innovante pour produire des catalyseurs solides hybrides à base de cristaux de protéines. Comme expliqué dans leur article publié dans Nano Letters le 12 juillet 2023, leur approche combine l'ingénierie cellulaire et un processus in vitro simple pour produire des catalyseurs pour la photosynthèse artificielle.
L’élément constitutif du catalyseur hybride est un monomère protéique dérivé d’un virus qui infecte le ver à soie Bombyx mori. Les chercheurs ont introduit le gène qui code pour cette protéine dans la bactérie Escherichia coli, où les monomères produits formaient des trimères qui, à leur tour, s'assemblaient spontanément en cristaux de polyèdres stables (PhC) en se liant les uns aux autres via leur hélice α N-terminale (H1). ).
De plus, les chercheurs ont introduit une version modifiée du gène de la formiate déshydrogénase (FDH) provenant d’une espèce de levure dans le génome d’E. coli. Ce gène a amené la bactérie à produire des enzymes FDH avec des terminaisons H1, conduisant à la formation de cristaux hybrides H1-FDH@PhC dans les cellules.
L'équipe a extrait les cristaux hybrides de la bactérie E. coli par sonication et centrifugation en gradient, et les a trempés dans une solution contenant un photosensibilisateur artificiel appelé éosine Y (EY). En conséquence, les monomères protéiques, qui avaient été génétiquement modifiés de telle sorte que leur canal central puisse héberger une molécule d'éosine Y, ont facilité la liaison stable de l'EY au cristal hybride en grande quantité.
Grâce à cet ingénieux processus, l'équipe a réussi à produire des catalyseurs EY·H1-FDH@PhC hautement actifs, recyclables et thermiquement stables, capables de convertir le dioxyde de carbone (CO2 ) en formate (HCOO − ) lors de l'exposition à la lumière, imitant la photosynthèse. De plus, ils ont conservé 94,4 % de leur activité catalytique après immobilisation par rapport à celle de l'enzyme libre.
"L'efficacité de conversion du cristal hybride proposé était d'un ordre de grandeur supérieur à celle des composés précédemment rapportés pour la photosynthèse artificielle enzymatique basée sur la FDH", explique le professeur Ueno. "De plus, les PhC hybrides sont restées à l'état d'assemblage de protéines solides après avoir subi des processus d'ingénierie in vivo et in vitro, démontrant la remarquable capacité de cristallisation et la forte plasticité des PhC en tant qu'échafaudages d'encapsulation."
Dans l’ensemble, cette étude met en valeur le potentiel de la bio-ingénierie pour faciliter la synthèse de matériaux fonctionnels complexes. "La combinaison de techniques in vivo et in vitro pour l'encapsulation de cristaux de protéines constituera probablement une stratégie efficace et respectueuse de l'environnement pour la recherche dans les domaines des nanomatériaux et de la photosynthèse artificielle", conclut le professeur Ueno.
Plus d'informations : Tiezheng Pan et al, Ingénierie cellulaire de cristaux de protéines dans des catalyseurs solides hybrides pour la photosynthèse artificielle, Nano Letters (2023). DOI :10.1021/acs.nanolett.3c02355
Informations sur le journal : Lettres nano
Fourni par l'Institut de technologie de Tokyo