Les vaccins à ARN messager (ARNm) révolutionnent le traitement du cancer. Ils peuvent être développés de manière flexible sur une courte période, permettant l’expression transitoire de plusieurs antigènes pour une immunisation sûre et efficace. Une diversité de vaccins à ARNm est explorée en clinique pour bénéficier aux patients atteints de cancer.
Cependant, la traduction des vaccins à ARNm est toujours entravée par des barrières d’administration en plusieurs étapes avant le déclenchement d’une forte immunité, notamment une clairance rapide, un mauvais ciblage des organes lymphoïdes et des cellules dendritiques, une hydrolyse catalytique et une faible capacité à traverser les bicouches phospholipidiques. De plus, la vaccination avec l’ARNm seul peut à peine induire de fortes réponses immunitaires en l’absence d’adjuvants. Il reste difficile d'améliorer l'administration cytosolique de l'ARNm et de promouvoir son efficacité vaccinale in vivo en association avec des adjuvants.
Au cours des dernières décennies, il a été rapporté qu’un grand nombre de nanoporteurs favorisaient l’efficacité de la transfection de médicaments à base d’acide nucléique ou administraient des médicaments aux ganglions lymphatiques. Ces études fournissent des caractéristiques précieuses, notamment la taille, la charge de surface, la modification, la réactivité, les composants et la cytotoxicité, pour atteindre l'objectif de drainage des ganglions lymphatiques ou d'accès cytosolique.
Les techniques d’apprentissage automatique fournissent des outils puissants pour explorer les caractéristiques physicochimiques et biologiques de ces nanoparticules et facilitent la conception de nanoporteurs avec une grande efficacité. Généralement, les modèles d'apprentissage automatique ont été formés, sélectionnés et optimisés avec des ensembles de données massifs et de haute qualité issus de calculs et de données expérimentales à haut débit, et guident à leur tour la conception rationnelle, le criblage et l'optimisation des nanoporteurs.
En exploitant les bases de données existantes sur les nanosupports, l'apprentissage automatique peut fournir des informations sur la conception rationnelle de nanovaccins à haute efficacité.
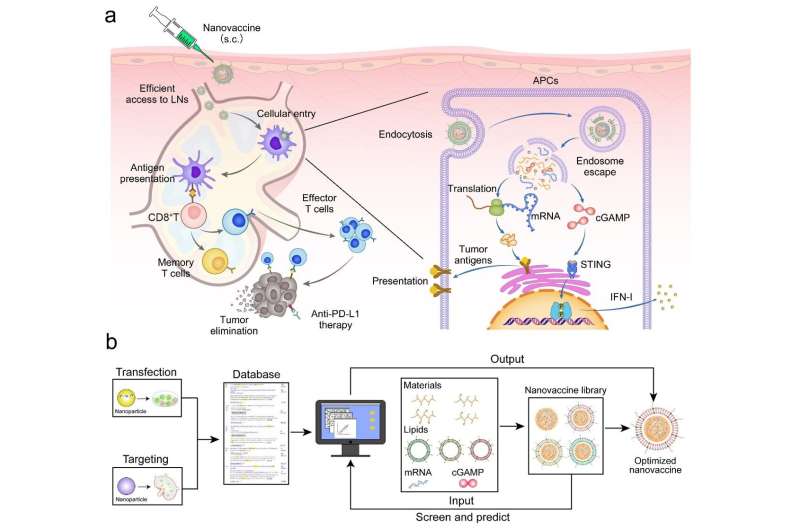
Dans un nouvel article de recherche publié dans la National Science Review , des scientifiques de l’Académie chinoise des sciences et de l’Université Jiao Tong de Shanghai ont utilisé l’apprentissage automatique pour guider la conception rationalisée de nanovaccins à ARNm. Cette étude a identifié les paramètres clés des nanovaccins pour une délivrance efficace de l'ARNm et du GAMPc, sur la base d'un modèle d'apprentissage automatique de la base de données Nanocarrier.
Les nanocomplexes d'ARNm/cGAMP à base de polyéthylèneimine greffée d'acide phénylboronique ont été préparés et ensuite encapsulés avec des lipides anioniques pour obtenir le nanovaccin.
(1) La charge de surface négative du nanovaccin réduit l'interaction avec les glycosaminoglycanes chargés négativement dans la matrice et améliore l'accumulation dans les ganglions lymphatiques.
(2) Le nanovaccin, après avoir été internalisé par les cellules présentatrices d'antigènes (CPA) dans les ganglions lymphatiques, favorise la libération d'ARNm et de GAMPc des endosomes vers le cytoplasme, ce qui active la voie STING et induit la présentation d'antigènes tumoraux.
(3) L'activation de la voie STING favorise la libération d'IFN-I, qui active la réponse immunitaire des lymphocytes T pour tuer les cellules tumorales et inhiber la croissance tumorale et les métastases. Comparée à l'ARNm seul, la stratégie thérapeutique basée sur ce nanovaccin a démontré des effets antitumoraux plus forts dans les modèles de mélanome et de cancer colorectal.
L'article est publié dans la revue National Science Review. .
Plus d'informations : Lei Zhou et al, Immunisation par ARNm renforcée par un agoniste STING via une conception intelligente de nanovaccins pour améliorer l'immunothérapie du cancer, National Science Review (2023). DOI : 10.1093/nsr/nwad214
Fourni par Science China Press