Récemment, l'équipe de l'académicien Huang Wei, du professeur Li Lin et du professeur Hu Wen Bo de l'école de l'université polytechnique du Nord-Ouest a développé un agent photothermique NIR-II ultra-efficace pour le traitement photothermique de l'ostéosarcome par laser à 1 064 nm.
L'étude intitulée "Acceptor Engineering Produces Ultrafast Nonradiative Decay in NIR-II Aza-BODIPY Nanoparticles for Efficient use. Osteosarcoma Photothermal Therapy via Concurrent Apoptosis and Pyroptosis", a été publiée dans Research .
Le traitement du cancer reste aujourd’hui l’un des plus grands défis auxquels sont confrontés les gens, malgré une technologie médicale nettement améliorée. Ces dernières années, le développement d'agents photothermiques (PAT) dans le proche infrarouge (NIR), qui sont des médicaments moléculaires ciblés pour la thérapie photothermique (PTT), est devenu un nouveau point chaud de la recherche.
Par rapport à d'autres bandes de lumière, la lumière NIR a une meilleure capacité de pénétration biologique et peut être utilisée pour un PTT léger des tissus profonds lorsqu'elle est combinée avec des PAT appropriés. La majorité des expériences sur des modèles de souris en sont encore au stade du traitement des tumeurs sous-cutanées, qui est limité par la faible profondeur de pénétration de la lumière NIR-I et ne peut pas éliminer les tissus tumoraux profonds dans le corps.
Cependant, la profondeur de pénétration de la lumière NIR-II augmente et le PTT profond des tumeurs devrait trouver une application clinique. Il existe actuellement de nombreuses études sur les PTA et divers nouveaux matériels sont fréquemment développés. Les facteurs qui affectent le fonctionnement des PTA comprennent la longueur d'onde d'absorption, la taille et la modification de la surface.
Bien que différents types de PTA présentent des avantages uniques, un matériau photothermique intégrant de nombreux avantages tels qu'un rendement de conversion photothermique (PCE) élevé, une longue longueur d'onde d'absorption, une forte biosécurité et une bonne solubilité dans l'eau doit être exploré.
Les PTA à petites molécules avec une absorption intense du NIR-II et des PCE élevés sont des candidats prometteurs pour le traitement des tumeurs profondes telles que l'ostéosarcome. Jusqu'à présent, le développement de PTA NIR-II à petites molécules reposait en grande partie sur la fabrication de structures donneur-accepteur-donneur (D-A-D/D') et un succès limité a été obtenu.
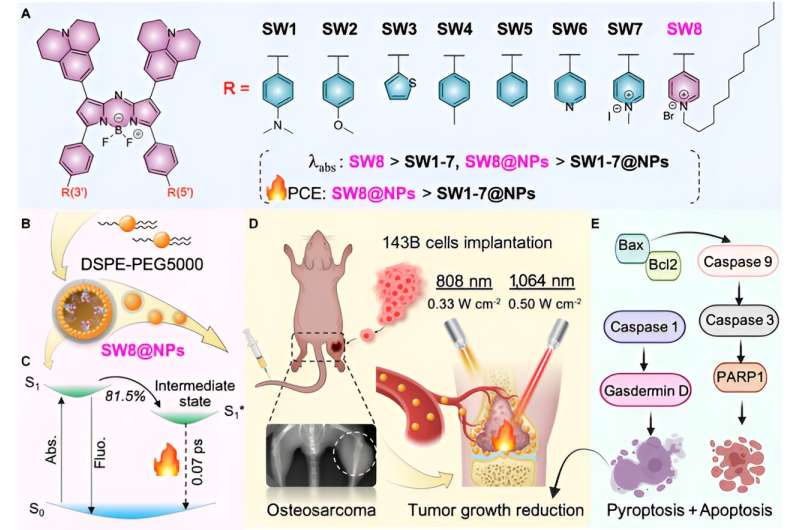
Ici, grâce à l'ingénierie des accepteurs, un PTA (SW8) NIR-II aza-bore-dipyrrométhène (aza-BODIPY) structuré donneur-accepteur-accepteur (D – A – A ') a été facilement développé pour le photothéranostique médié par laser à 1 064 nm. traitement de l'ostéosarcome.
Le changement des groupes donneurs en groupes accepteurs a produit des décalages vers le rouge remarquables des maximums d'absorption des régions NIR-I (~ 808 nm) vers celles NIR-II (~ 1 064 nm) pour les aza-BODIPY (SW1 à SW8). De plus, SW8 s'auto-assemble en nanoparticules (SW8@NP) avec une absorption NIR-II intense et un PCE ultra élevé (75 %, 1 064 nm).
Ce PCE ultra-élevé provenait principalement d'une voie de désintégration non radiative supplémentaire, qui présentait un taux de désintégration 100 fois supérieur à celui montré par les voies conventionnelles telles que la conversion interne et la relaxation vibratoire. Finalement, les SW8@NP ont réalisé un PTT NIR-II très efficace à médiation laser de 1 064 nm de l'ostéosarcome via l'apoptose et la pyroptose simultanées.
Ce travail illustre non seulement une approche à distance pour traiter les tumeurs profondes avec un contrôle spatio-temporel élevé, mais fournit également une nouvelle stratégie pour construire des PTA NIR-II à petites molécules hautes performances.
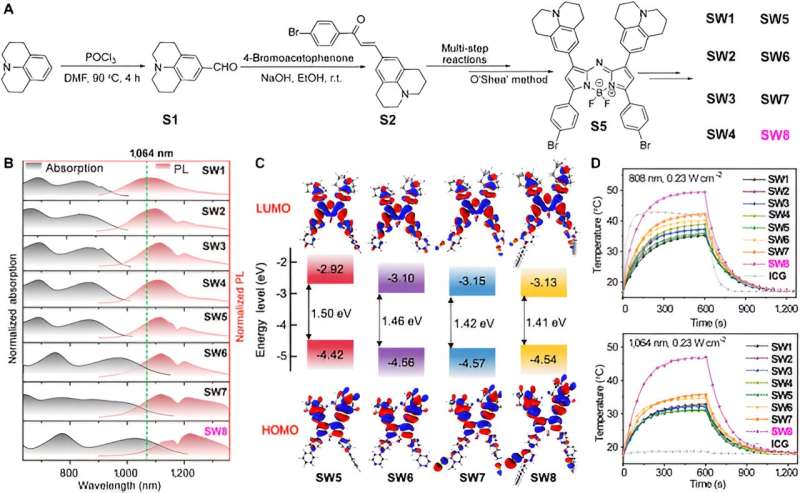
Tout d’abord, les chercheurs ont synthétisé une série de PTA organiques à petites molécules basées sur l’aza-BODIPY. Notamment, des décalages vers le rouge remarquables pour les spectres d'absorption et PL se sont produits de SW5 à SW6, où le donneur de benzène donneur d'électrons (D') a été remplacé par l'accepteur de pyridine (A').
Une augmentation supplémentaire du déficit électronique de A 'a provoqué davantage de longueurs d'onde bathochrome de SW6 à SW8, en particulier le décalage vers le rouge de la longueur d'onde d'absorption qui est évident, alors que le fragment donneur d'électrons (de SW1 à SW5) ne présentait aucun décalage de longueur d'onde prononcé. De plus, l’introduction de chaînes alkyles a amélioré l’agrégation J des molécules, qui se manifeste par un décalage vers le rouge de la longueur d’onde d’émission de SW6 à SW8. Les calculs de la théorie fonctionnelle de la densité dépendant du temps (TD-DFT) ont révélé une diminution progressive de l'écart énergétique HOMO-LUMO de SW5 à SW8, cohérent avec les spectres décalés vers le rouge.
Notamment, les niveaux d'énergie LUMO pour SW5–8 ont diminué dans l'ordre, alors que les niveaux d'énergie HOMO sont restés presque inchangés. Ce phénomène indique que les segments accepteurs aux positions 3 et 5 de l'aza-BODIPY ont considérablement réduit les écarts énergétiques, offrant une approche alternative pour construire de nouveaux matériaux organiques NIR-II à petites molécules.
Ensuite, cet article sélectionne la longueur d'onde d'absorption/émission SW8 la plus avantageuse pour l'auto-assemblage. SW8 a été encapsulé dans une matrice amphiphile pour former des nanoparticules hydrosolubles (SW8@NP). Le PCE des SW8@NP sous irradiation laser de 1 064 nm a été déterminé comme pouvant atteindre 75 %, ce qui constitue une amélioration remarquable par rapport à ceux des SW1-7@NP.
De plus, des études spectroscopiques ultrarapides ont attribué ce PCE ultra-élevé à un état intermédiaire non radiatif. Cet intermédiaire sombre a épuisé jusqu'à 80 % de la population excitée avec un taux de désintégration élevé de 1,3 × 10 13 . s -1 par rapport aux canaux de désintégration non radiatifs conventionnels tels que la conversion interne, ce qui entraîne un PCE ultra élevé.
Enfin, afin d'étudier la biocompatibilité des SW8@NP, la cellule d'ostéosarcome 143B a été traitée avec SW8@NP. Les résultats ont montré que les SW8@NP pouvaient être efficacement absorbés par les cellules 143B avec une faible toxicité dans l'obscurité et une phototoxicité élevée. Le niveau d’apoptose a augmenté de manière significative après 808 nm et 1 064 images photothermiques ont été prises. L’imagerie aux rayons X a été utilisée pour surveiller la croissance tumorale orthotopique. les tumeurs ont été irradiées au laser pendant 10 minutes et répétées tous les deux jours pendant 12 jours.
La courbe de tendance volumique pour le groupe « laser SW8@NPs +1 064 nm » a démontré une éradication complète de la tumeur au cours des 12 jours de suivi. En revanche, les cinq autres traitements n’ont pas réussi à supprimer la croissance tumorale, avec une augmentation moyenne du volume tumoral de 4 à 5 fois par irradiation laser nm. Comparé au laser 808 nm, le laser 1 064 nn peut pénétrer dans un tissu musculaire de 15 mm d'épaisseur et stimuler efficacement la production de chaleur SW8@NP. D'autres études sur des souris orthotopiques porteuses de tumeur 143B ont montré que les SW8@NP présentaient une accumulation élevée et un fort effet photothermique au niveau du site de la tumeur. Irradiation continue des régions tumorales pendant 10 minutes à l'aide d'un appareil 808 (0,33 W cm -2 ) ou laser 1 064 nm (0,5 W cm -2 ) a été réalisée 24 h après l'injection de SW8@NPs.
De plus, les tests histologiques et immunohistochimiques ont montré que la structure tumorale dans le groupe "SW8@NPs+1 064 nm" était gravement endommagée et que les cellules parenchymateuses disparaissaient en grand nombre et semblaient vacuolaires, et les résultats TUNEL ont montré que le niveau d'apoptose était significativement augmenté. Le Western blot a été utilisé pour analyser les protéines associées à l'apoptose (Bax, Bcl2, Caspase 9, Caspase 3 et PARP1).
Dans le groupe « SW8@NPs+1 064 nm », le niveau global de phosphorylation de la protéine apoptotique a été augmenté et l'apoptose a été activée par irradiation. Ensemble, les résultats ont révélé, pour la première fois, que le PTT NIR-II médié par SW8@NPs exerçait des effets antitumoraux principalement en stimulant l'apoptose et la pyroptose concomitantes.
Dans cette étude, ils ont rendu compte de la conception d’une nouvelle petite molécule organique PTA (SW8) et de nanoparticules auto-accessibles (SW8@NPs) avec un PCE élevé (75 %) dans la fenêtre NIR-II (1 064 nm). L'analyse de la dynamique moléculaire des états excités a montré que ce PCE ultra-élevé provenait principalement d'une voie de désintégration non radiative supplémentaire.
Une série d'expériences in vitro et in vivo ont démontré pour la première fois qu'un PTT NIR-II supérieur pouvait induire efficacement l'apoptose et la pyroptose simultanées dans les tissus d'ostéosarcome. Les chercheurs suggèrent que la conception de PTA organiques à petites molécules basées sur des principes rationnels dans la fenêtre NIR-II bénéficiera aux applications cliniques pratiques des activations et des traitements photothermiques à l'avenir.
Plus d'informations : Zhenxiong Shi et al, Acceptor Engineering produit une décroissance non radiative ultrarapide dans les nanoparticules NIR-II Aza-BODIPY pour une thérapie photothermique efficace de l'ostéosarcome via l'apoptose et la pyroptose simultanées, Recherche (2023). DOI :10.34133/research.0169
Informations sur le journal : Recherche
Fourni par Recherche