Toutes les cellules sécrètent naturellement des vésicules extracellulaires à l’échelle nanométrique sous forme de particules délimitées par des bicouches lipidiques. Ce sont donc des biomarqueurs valables pour identifier une variété de maladies.
Il est important d'isoler efficacement les petites vésicules extracellulaires tout en maintenant le rendement et la pureté pour explorer leur potentiel dans les applications diagnostiques, pronostiques et thérapeutiques.
Les méthodes conventionnelles d'isolement présentent des inconvénients, notamment une pureté et un rendement faibles, des procédures d'extraction longues, des équipements spécialisés et des coûts élevés.
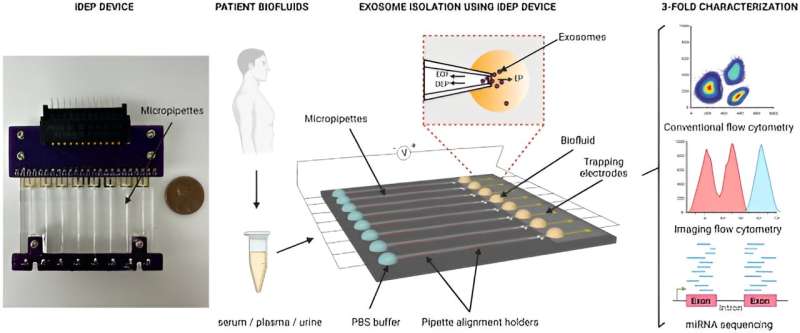
Dans une étude publiée dans Scientific Reports , Manju Sharma et une équipe de scientifiques en génie biomédical de l'Université de Cincinnati dans l'Ohio aux États-Unis, ont développé un nouveau dispositif diélectrophorétique à base d'isolant pour isoler rapidement les petites vésicules extracellulaires des biofluides et des milieux de culture cellulaire, en fonction de leurs propriétés diélectriques.
Les scientifiques ont caractérisé les petites vésicules extracellulaires isolées des biofluides de patients atteints de cancer à l'aide de l'instrument et ont mené une triple caractérisation avec la cytométrie en flux conventionnelle, la cytométrie en flux par imagerie avancée et le séquençage de microARN pour obtenir un rendement élevé de vésicules extracellulaires pures. La plateforme est efficace pour isoler rapidement les biomarqueurs et maintenir l'intégrité biomoléculaire des vésicules.
Biologiquement, les petites vésicules extracellulaires sont des vaisseaux biologiques encapsulés dans une membrane que l'on trouve dans les biofluides tels que le sang, l'urine, la salive, le sperme, le lait maternel et le liquide céphalo-rachidien ; libéré par les cellules dans l'espace extracellulaire.
De telles vésicules à l’échelle nanométrique peuvent transférer horizontalement leur cargaison biomoléculaire pour fonctionner comme vecteurs de signalisation intercellulaire. De telles vésicules extracellulaires offrent un degré élevé de sensibilité et de spécificité en raison de leur excellente stabilité. Leur détection précoce dans les biopsies liquides peut améliorer la détection des cancers, des infections et des maladies neurodégénératives et métaboliques.
L’isolement des vésicules est cependant difficile en raison de leur taille nanométrique et de leurs propriétés physicochimiques. Les méthodes d'isolement dépendent généralement des propriétés des vésicules extracellulaires et, bien que de tels dispositifs présentent des attributs prometteurs, leur coût de fabrication, la dilution des échantillons et leur sensibilité au colmatage constituent des défis inhérents.
En réponse, Sharma et ses collègues ont développé une nouvelle approche diélectrophorétique basée sur un isolant avec des micropiliers dans des canaux microfluidiques pour engloutir rapidement les nanoparticules en fonction de leur taille et de leurs propriétés diélectriques uniques.
Le dispositif maintient un ensemble de micropipettes capables d'isoler des nanoparticules de petits volumes d'échantillons en appliquant un champ électrique considérablement faible sur toute la longueur des pipettes. L'architecture de la géométrie des pores a permis l'isolement de vésicules extracellulaires à partir de petits volumes d'échantillons de milieux de culture cellulaire conditionnés et de biofluides provenant de donneurs sains.
Dans ce travail, Sharma et son équipe ont isolé les biofluides de patients atteints de cancer, notamment le sérum, le plasma et l'urine, suivis d'une caractérisation multiparamétrique via la cytométrie en flux et le séquençage de miARN de nouvelle génération.
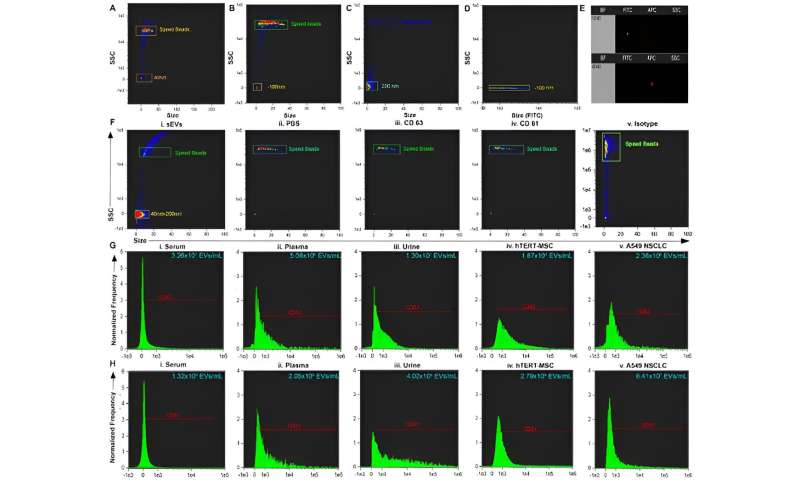
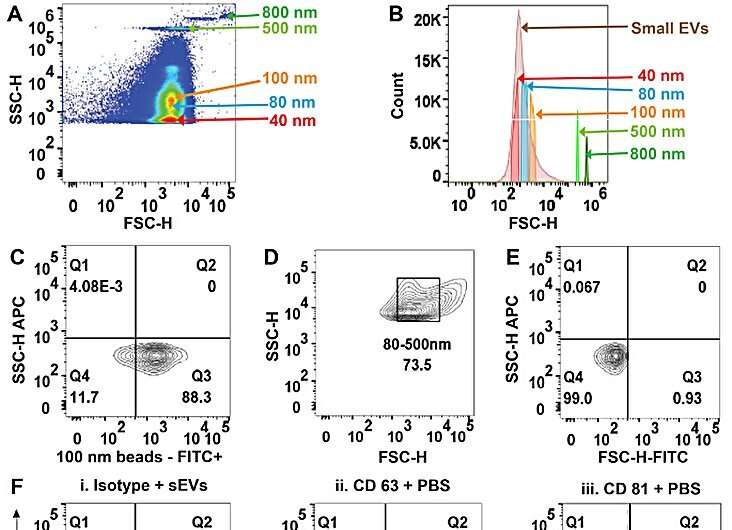
L’équipe a purifié de petites vésicules extracellulaires à partir de sérum, de plasma et d’urine dans une solution saline tamponnée au phosphate en utilisant l’approche diélectrophorétique basée sur un isolant. Sharma et ses collègues ont utilisé la microscopie électronique à transmission pour confirmer la présence des vésicules et ont exploré l'analyse multiparamétrique de petites vésicules extracellulaires circulantes purifiées via la cytométrie en flux.
L’équipe a isolé les vésicules et les a analysées, suivies d’études conventionnelles de cytométrie en flux. Les chercheurs ont en outre montré la capacité et l'utilisation de l'appareil en caractérisant les isolats grâce au logiciel ImageStream.
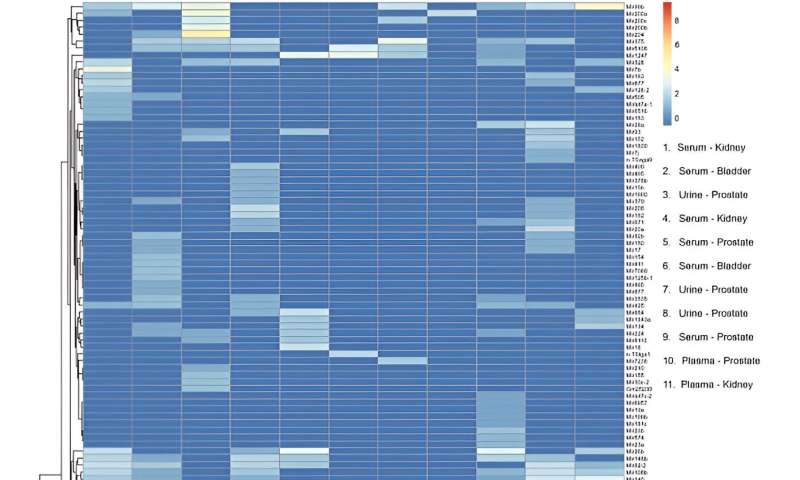
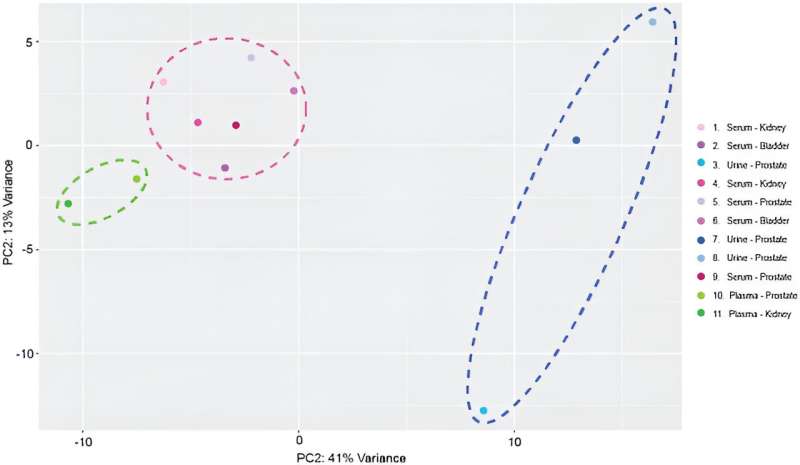
Après le séquençage des miARN, l’équipe a cartographié 137 transcrits distincts et matures de miARN sur le génome humain à travers des échantillons afin d’inclure le dispositif dans les flux de travail d’analyse des biomarqueurs miARN. Ils ont réalisé des profils transcriptomiques et effectué une analyse en composantes principales.
Perspectives
De cette manière, Manju Sharma et ses collègues ont montré la capacité et l'efficacité d'un dispositif diélectrophorétique basse tension et sans étiquette pour isoler de petites vésicules extracellulaires du sérum, du plasma et de l'urine de patients atteints de cancer grâce à la détection de particules submicroniques, et caractérisation multiparamétrique à l'aide de méthodes de cytométrie en flux conventionnelles et de méthodes avancées de cytométrie en flux.
Les concentrations d’ARN des travaux étaient comparables à celles des travaux antérieurs et confirmaient que la méthode d’isolement était une alternative viable à celles déjà établies en laboratoire. Les méthodes analytiques peuvent être utiles en tant que plates-formes de biopsie liquide pour isoler de petites vésicules extracellulaires et développer des plates-formes de diagnostic et de surveillance basées sur les vésicules extracellulaires.
Plus d'informations : Manju Sharma et al, Purification rapide et caractérisation multiparamétrique de petites vésicules extracellulaires circulantes à l'aide d'un laboratoire sur puce sans étiquette, Rapports scientifiques (2023). DOI :10.1038/s41598-023-45409-4
Informations sur le journal : Rapports scientifiques
© 2023 Réseau Science X