
Les transfusions de plaquettes sont essentielles à la gestion des saignements et du dysfonctionnement hémostatique et peuvent être étendues pour être utilisées comme thérapie cellulaire pour diverses maladies. Les efforts visant à créer de telles thérapies cellulaires nécessitent que les chercheurs modifient les plaquettes du donneur pour qu'elles expriment des protéines thérapeutiques. Cependant, à l'heure actuelle, les méthodes appropriées pour modifier génétiquement les plaquettes collectées auprès des donneurs de sang restent insaisissables.
Dans une nouvelle étude publiée dans Science Advances , Jerry Leung et une équipe de scientifiques en nanomédecine, biochimie et biologie moléculaire de l'Université de la Colombie-Britannique au Canada, de l'Université de Hokkaido au Japon et de diverses institutions aux États-Unis ont décrit une approche basée sur des nanoparticules lipidiques optimisées pour les plaquettes contenant de l'ARNm. pour l'expression de protéines exogènes dans les plaquettes humaines et de rat.
Lorsque l’équipe a testé la bibliothèque de nanoparticules d’ARNm-lipides, l’expression résultante des protéines exogènes n’était pas en corrélation avec l’activation plaquettaire. Les plaquettes transfectées ont conservé leur fonction hémostatique et se sont accumulées dans les zones de lésions vasculaires après transfusion à des rats, avec la capacité d'étendre le potentiel thérapeutique des plaquettes.
Les plaquettes font partie intégrante de l'hémostase et sont régulièrement transfusées pour rétablir l'équilibre hémostatique chez les patients. Ces plaquettes peuvent être étendues au-delà des indications telles que les thérapies cellulaires pour traiter la septicémie, l'inflammation et l'arthrite. Les plaquettes génétiquement modifiées peuvent créer de nouvelles thérapies cellulaires exprimant des protéines thérapeutiques, qui peuvent être mises en œuvre pour modifier les plaquettes du donneur. Les méthodes existantes d'électroporation, de vecteurs viraux et de transfection commerciale n'ont pas permis d'éditer les plaquettes du donneur et d'exprimer des protéines exogènes.
Les approches indirectes peuvent exprimer des protéines exogènes dans les plaquettes ou les particules de type plaquette en ciblant les cellules souches précurseurs des plaquettes avec des vecteurs lentiviraux. Les plaquettes dérivées du donneur doivent être fonctionnellement modifiées pour créer d'authentiques thérapies cellulaires plaquettaires.
Des tentatives antérieures de transfection de plaquettes avec des nanoparticules lipidiques contenant de l'ARNm ont montré la possibilité d'une délivrance d'ARNm dans les plaquettes, tandis que les progrès de la technologie des nanoparticules lipidiques ont amélioré son potentiel pour atteindre une population plus large.
Dans ce travail, Leung et ses collègues ont rapporté des nanoparticules lipidiques d’ARNm pour leur capacité à transfecter directement les plaquettes du donneur pour exprimer des protéines exogènes. Ces plaquettes peuvent être modifiées avec des nanoparticules lipidiques d'ARNm pour maintenir leur fonction et s'accumuler localement dans les plaies et réguler l'homéostasie après transfusion chez des rats coagulopathiques.
Pour identifier les méthodes de transfection efficaces pour les plaquettes, l’équipe a livré un ARNm codant pour une enzyme NanoLuc luciférase (NanoLuc) à l’aide de plusieurs agents de transfection et a mesuré leur expression. Bien que NanoLuc n'ait pas été détecté dans les plaquettes traitées avec de l'ARNm libre sans agent de transfection ou en utilisant des agents de délivrance d'ARNm commerciaux, le processus a permis l'absorption de grandes quantités d'ARNm dans les plaquettes.
Leung et son équipe ont détecté l’expression de NanoLuc en utilisant une formulation de nanoparticules d’ARNm-lipides qui ressemblait à la petite nanoparticule d’ARN-lipides interférentes cliniquement prouvée pour traiter l’amylose héréditaire. L'équipe a comparé la quantité d'activation plaquettaire suite à la transfection de nanoparticules lipidiques d'ARNm à des plaquettes non traitées.
Pour identifier la formulation de nanoparticules d’ARNm-lipides la plus adaptée au transport des plaquettes, ils ont optimisé trois composants principaux :les lipides ionisables, les lipides de liaison et le lipide polyéthylèneglycol. Ils ont criblé 10 lipides ionisables et deux lipides cationiques permanents et ont mesuré leur expression protéique, leur absorption et leur activation d'ARNm pour soutenir la synthèse protéique.
Actions des nanoparticules lipidiques fonctionnalisées en laboratoire
Pour examiner comment la combinaison de lipides ionisables et auxiliaires a des effets synergiques pour améliorer l'expression des protéines tout en minimisant l'activation plaquettaire, l'équipe a étudié deux lipides ionisables approuvés par la FDA. Outre leur composition lipidique, les éléments d’ARNm ont joué un rôle important dans la promotion d’une synthèse efficace des protéines exogènes. Les nanoparticules lipidiques contenant des lipides auxiliaires avec une tête de phosphocholine, ainsi que des lipides avec des groupes de queue ramifiés ou insaturés, étaient les plus adaptées à la transfection plaquettaire et pour générer des niveaux d'expression plus élevés.
Parmi les modifications de l'ARN testées dans ce travail, Leung et ses collègues ont noté l'uridine non modifiée, ou pseudouridine, pour faciliter des niveaux d'expression plus élevés de fluorescence. Ils ont ensuite observé si l'expression de la fluorescence dépendait du degré d'activation plaquettaire ou de la quantité d'ARN délivrée, qu'ils ont étudié à l'aide d'une analyse matricielle de corrélation.
Bien que l’expression de la fluorescence ne soit pas fortement corrélée aux niveaux de plaquettes en surface ou à l’absorption de l’ARNm, ils ont noté une légère corrélation positive entre la quantité d’ARN délivrée et l’activation des plaquettes. Puisque l'expression de NanoLuc n'était pas fortement corrélée aux niveaux de plaquettes de surface ou à l'absorption de l'ARNm, l'équipe a testé la possibilité d'influencer son expression en activant les plaquettes à l'aide d'agonistes avant et après la transfection de nanoparticules lipidiques d'ARNm.
Les plaquettes stimulées avec de l'adénosine diphosphate, par exemple, un peptide lié au collagène réticulé ou de la thrombine avant le traitement par nanoparticules ARNm-lipides, avaient une expression de fluorescence significativement inférieure. Lorsque Leung et l’équipe ont stimulé les plaquettes avec des agonistes pendant plus de deux heures, elles ont subi un réarrangement substantiel du transcriptome et du protéome. Les résultats ont montré que la traduction de l'ARNm exogène ne nécessite pas d'activation plaquettaire.
Lorsque l’équipe a traité les plaquettes avec des nanoparticules lipidiques d’ARNm, elles ont maintenu leur fonction hémostatique in vitro et ont montré une grande sensibilité à leur environnement physique et chimique. L'équipe a étudié si les plaquettes pouvaient encore être activées après la transfection de nanoparticules ARNm-lipides et a mesuré leur état d'activation et leur réponse aux agonistes physiologiques.
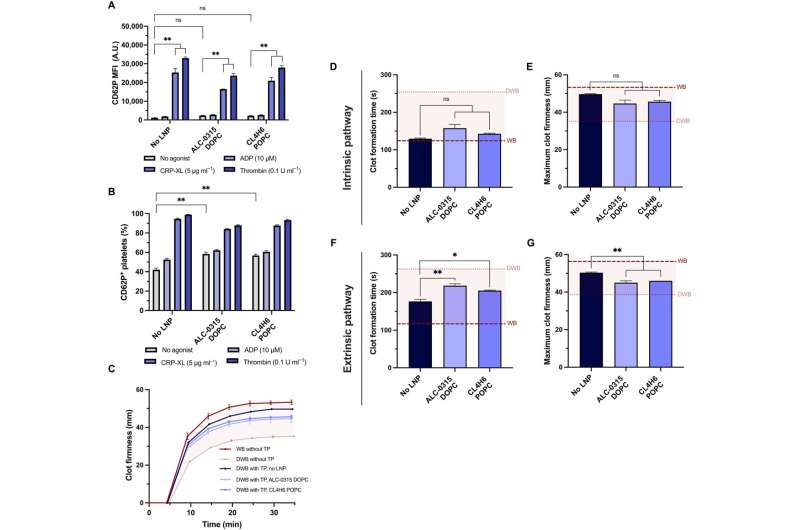
L’équipe a testé la capacité des plaquettes transfectées à conserver leur potentiel à contribuer à la fermeté et au taux de formation de caillots en utilisant un modèle de thromboélastométrie rotationnelle et un modèle ex vivo pour tester l’activité plaquettaire dans le sang total. Les chercheurs ont modélisé la coagulopathie de dilution en utilisant du sang total dilué et des plaquettes préparées dans un emballage transfusionnel.
Lorsqu’ils ont combiné le paquet de transfusion avec du sang total dilué pour modéliser la maladie telle qu’elle survient chez un patient, ils ont noté que les nanoparticules lipidiques n’affectaient pas la coagulopathie plaquettaire in vitro. De plus, l'équipe a exploré l'expression de plaquettes transfectées avec des nanoparticules lipidiques d'ARNm exprimées avec NanoLuc, circulant et localisées dans les sites de plaies après transfusion chez des rongeurs coagulopathiques.
De cette manière, Jerry Leung et ses collègues ont ciblé l’administration de molécules et de thérapies cellulaires dans des sites vasculaires d’intérêt en utilisant les plaquettes naturellement compétentes qui peuvent intrinsèquement accomplir cette tâche. L'équipe a développé des nanoparticules lipidiques et des ARNm optimisés pour les plaquettes pour une expression protéique réussie, tout en présentant la fonction circulaire des plaquettes et leur accumulation locale au niveau du site vasculaire d'intérêt.
Il est possible de réaliser l’administration d’acides nucléiques et la traduction exogène à l’aide de nanoparticules d’ARNm-lipides optimisées pour les plaquettes afin d’élargir et de concevoir des plaquettes pour une variété d’applications cliniques. Ces plaquettes de donneur conçues avec des nanoparticules d'ARNm-lipides peuvent traiter les troubles hémorragiques aigus avec des applications plus larges en oncologie. Ces plaquettes transfusées avec des nanoparticules optimisées d'ARNm-lipides sont fonctionnellement transfusables et peuvent s'accumuler au niveau du système vasculaire pour des thérapies plaquettaires efficaces visant à moduler les troubles hématologiques.
Plus d'informations : Jerry Leung et al, Plaquettes transfusables génétiquement modifiées utilisant des nanoparticules lipidiques d'ARNm, Science Advances (2023). DOI :10.1126/sciadv.adi0508
Informations sur le journal : Progrès scientifiques
© 2023 Réseau Science X