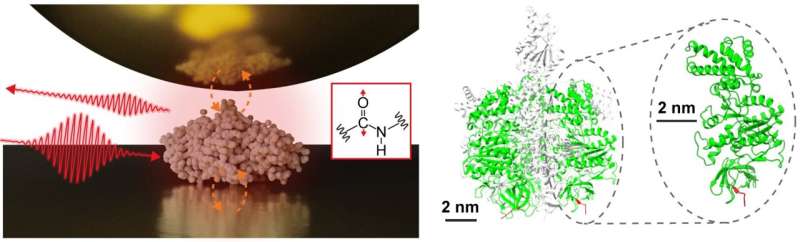
Une équipe de recherche interdisciplinaire, dirigée par le professeur adjoint Jun Nishida et le professeur associé Takashi Kumagai de l'Institut des sciences moléculaires, a observé avec succès les spectres vibrationnels de protéines uniques, constitués d'environ 500 résidus d'acides aminés, en utilisant des techniques de mesure avancées basées sur microscopie optique de terrain. Cette méthode utilise la lumière confinée à l'échelle nanométrique, permettant l'analyse détaillée d'échantillons extrêmement petits, ce qui représentait auparavant un défi avec la spectroscopie infrarouge conventionnelle.
L'étude est publiée dans la revue Nano Letters .
La spectroscopie infrarouge conventionnelle a été largement utilisée pour l'analyse structurelle et chimique de divers matériaux, car elle peut mesurer des spectres vibrationnels, souvent appelés « empreintes moléculaires ».
Cette nouvelle réalisation représente une avancée majeure vers des innovations technologiques telles que l'imagerie infrarouge ultra-sensible et super-résolution, ainsi que la spectroscopie vibrationnelle à molécule unique.
Le développement rapide de la nanotechnologie ces dernières années a conduit à une demande croissante d’imagerie infrarouge à ultra-haute sensibilité et à super-résolution. Cependant, la spectroscopie infrarouge conventionnelle est limitée dans la mesure des échantillons extrêmement petits ou dans l’obtention d’une résolution spatiale à l’échelle nanométrique. Par exemple, même la microspectroscopie infrarouge avec une bonne sensibilité nécessite plus d'un million de protéines pour obtenir un spectre infrarouge, ce qui rend impossible la mesure d'une seule protéine.
Dans leur étude, l'équipe de recherche a isolé une seule protéine, une sous-unité comprenant un complexe protéique appelé F1 -ATPase, sur un substrat d'or et réalisé des mesures de spectroscopie infrarouge en champ proche dans un environnement ambiant.
Ils ont réussi à acquérir le spectre vibrationnel infrarouge d’une seule protéine, ce qui représente une avancée majeure qui pourrait conduire à la caractérisation des organisations structurelles locales de protéines individuelles. Ces informations sont particulièrement importantes pour comprendre les fonctions sophistiquées des complexes protéiques et des protéines membranaires, offrant ainsi une compréhension plus approfondie de leurs mécanismes et interactions.
De plus, ils ont développé un nouveau cadre théorique décrivant les interactions à l'échelle nanométrique entre le champ proche infrarouge et les protéines.
Sur la base de cette théorie, l’équipe a pu reproduire quantitativement les spectres vibratoires expérimentaux observés. Ces résultats seront inestimables pour l'analyse chimique des biomolécules ainsi que de divers nanomatériaux, ouvrant la voie à une gamme d'applications de spectroscopie infrarouge à l'échelle nanométrique.
Plus d'informations : Jun Nishida et al, Interactions en champ proche sous-pointe-rayon dans la spectroscopie vibrationnelle nano-FTIR sur des protéines uniques, Nano Letters (2024). DOI :10.1021/acs.nanolett.3c03479
Informations sur le journal : Lettres nano
Fourni par les Instituts nationaux des sciences naturelles