Les maladies auto-immunes sont mystérieuses. Ce n’est que dans les années 1950 que les scientifiques ont réalisé que le système immunitaire pouvait endommager les organes de son propre corps. Même aujourd'hui, les causes fondamentales et le fonctionnement interne de la plupart des maladies auto-immunes restent mal compris, ce qui limite les options de traitement pour bon nombre de ces maladies.
Cependant, au cours des dernières années, la recherche a trouvé des indices sur la manière dont les maladies auto-immunes pourraient survenir. Cette recherche a montré que l'ADN attaché à de petites particules dans la circulation sanguine est probablement responsable de nombreuses maladies auto-immunes, en particulier le lupus érythémateux disséminé, ou simplement le lupus en abrégé, qui touche principalement les jeunes femmes et peut provoquer des lésions rénales.
Cependant, en raison de la grande variété de tailles des particules et de l'ADN dans le sang, il a été extrêmement difficile de déterminer dans quelle mesure et dans quelles circonstances ces combinaisons ADN-particules jouent un rôle dans la maladie.
Des chercheurs de l'Université Duke ont désormais mis au point un moyen de tester systématiquement la façon dont ces particules liées à l'ADN interagissent avec le système immunitaire. En utilisant de minuscules particules de tailles spécifiques, en attachant des brins d'ADN de certaines longueurs et en exposant les complexes résultants aux cellules immunitaires dans une boîte de laboratoire, les chercheurs montrent qu'une meilleure compréhension fondamentale de ces maladies pourrait être possible.
Les résultats ont été publiés dans les Actes de l'Académie nationale des sciences. .
"Notre approche a identifié la voie cellulaire qui provoque la réponse nocive à ces particules hybrides et a montré que l'ADN lié à la surface des nanoparticules est protégé contre la dégradation par les enzymes", a déclaré Christine Payne, professeure de génie mécanique et de science des matériaux de la famille Yoh. . "Nous pensons qu'il s'agit de résultats extrêmement importants qui constitueront la base de futures études avec notre nouveau système."
Bien que l'ADN soit généralement enfermé dans le noyau d'une cellule, il pénètre souvent dans la circulation sanguine lorsque les cellules meurent ou sont attaquées par des virus et des bactéries. Alors que la plupart des « ADN acellulaires » ne durent que quelques minutes avant d’être dégradés par l’organisme, chez certaines personnes et dans certaines situations, ils peuvent persister beaucoup plus longtemps. Dans des travaux récents, des niveaux élevés d'ADN acellulaire ont été étroitement liés à la gravité des symptômes du lupus, et de nombreux médecins testent désormais des moyens de l'utiliser pour surveiller l'activité de la maladie.
L'ADN acellulaire peut échapper à l'élimination en grande partie en formant des complexes avec d'autres molécules ou en se fixant sur des particules naturelles. Selon l’origine de l’ADN, sa longueur peut varier de quelques centaines à plusieurs milliers de paires de bases. Et les particules qu'il peut attacher ont un diamètre compris entre 100 et 1 000 nanomètres.
"Expérimenter avec les particules réellement présentes dans le sang est difficile car elles se présentent sous de nombreuses tailles et combinaisons différentes", a déclaré le Dr David Pisetsky, professeur de médecine et d'immunobiologie intégrative à la faculté de médecine de l'université Duke.
"Là où des travaux antérieurs se sont concentrés sur l'utilisation de nanoparticules à des fins thérapeutiques, nous explorons ici l'utilisation de participes pour comprendre les mécanismes de la maladie, ce qui peut être très instructif pour des questions médicales importantes." Payne a travaillé avec des membres de son laboratoire pour fabriquer des particules synthétiques étroitement contrôlées aux deux extrémités du spectre de taille naturel.
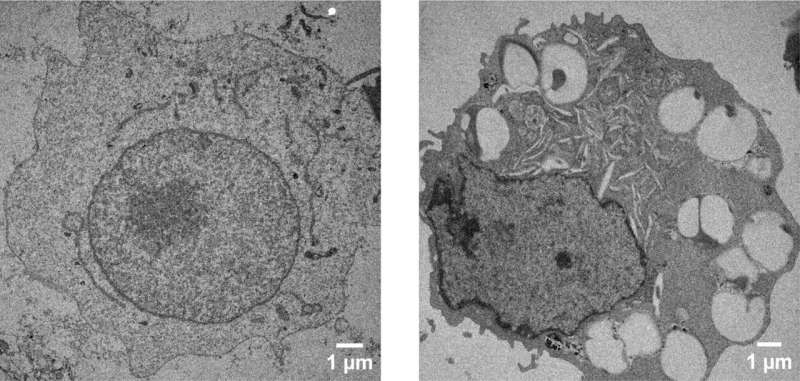
Ils ont ensuite attaché des brins d’ADN d’E. Coli, longs de quelques centaines de paires de bases ou de 10 000 paires de bases, à des particules grandes et petites. Avec une large gamme de complexes ADN-particules synthétiques en main, ils ont mélangé diverses combinaisons avec des macrophages humains, un type de globule blanc qui entoure et tue les micro-organismes, élimine les cellules mortes et stimule l'action d'autres cellules immunitaires.
"J'ai rejoint le laboratoire il y a plus d'un an et j'ai travaillé sur la caractérisation des couronnes de nanoparticules pour comprendre leur taille, leur quantité d'ADN et comment l'ADN se dégrade", a déclaré Diego Montoya, étudiant de troisième année travaillant dans le laboratoire de Payne et chercheur. co-auteur de l'article. "Cela a été très amusant et un privilège de travailler avec tout le monde sur cette recherche."
La première observation importante faite par l'équipe était que l'ADN attaché aux nanoparticules était protégé des enzymes dégradantes et que les nanoparticules plus grosses offraient une meilleure protection.
"Nous pensons que les enzymes pourraient ne pas être en mesure d'accéder à l'ADN pour le détruire en raison de la forme que prend l'ADN avec la surface de la nanoparticule", a déclaré Faisal Anees, titulaire d'un doctorat. étudiant dans le laboratoire de Payne. "Mais il pourrait y avoir d'autres effets, c'est donc une question à laquelle nous essayons de répondre de manière plus définitive maintenant."
Les résultats ont montré que les macrophages répondaient à tous les types de complexes ADN-particules en produisant des signaux inflammatoires que d’autres cellules suivraient, caractéristique de nombreuses maladies auto-immunes. Ils ont également démontré que cette réponse est créée par une voie de signalisation spécifique appelée cGAS-STING.
Les chercheurs soulignent que les résultats combinés ne fournissent pas encore une preuve irréfutable de la cause du lupus ou d'autres maladies auto-immunes, qui sont probablement variées et nuancées.
"Toutes les façons dont le système immunitaire s'attaque lui-même sont vraiment complexes, difficiles à comprendre et difficiles à traiter", a déclaré Payne. "Cette approche donne aux chercheurs un moyen d'approfondir et d'identifier des facteurs qu'ils ne pourraient pas faire avec un système purement biologique."
"Nous disposons désormais d'un système modèle bien défini qui nous permet de poser ces questions sur la causalité par rapport à la corrélation", a ajouté Pisetsky, qui étudie les maladies auto-immunes depuis près d'un demi-siècle. "Cela nous donne également une nouvelle méthode pour explorer des thérapies potentielles."
Plus d'informations : Faisal Anees et al., La couronne d'ADN sur les nanoparticules conduit à un effet immunostimulateur accru avec des implications pour les maladies auto-immunes, Actes de l'Académie nationale des sciences (2024). DOI : 10.1073/pnas.2319634121
Informations sur le journal : Actes de l'Académie nationale des sciences
Fourni par l'Université Duke