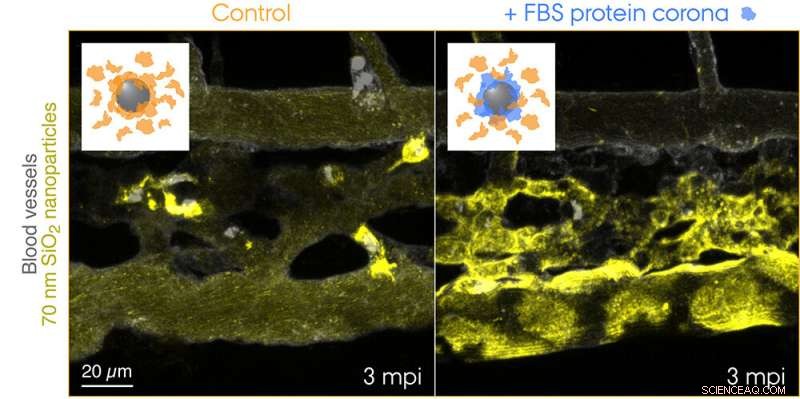
Des nanoparticules de SiO2 de 70 nm marquées par fluorescence ont été injectées dans la circulation sanguine d'embryons de poisson zèbre transgéniques âgés de 3 jours et imagées en direct 3 min après l'injection. Les encarts montrent des schémas pour les deux conditions testées :des nanoparticules de contrôle avec une couronne de protéines endogènes (orange) et des nanoparticules avec une couronne préformée de protéines de sérum bovin fœtal (FBS) (bleu) et des protéines endogènes supplémentaires. Les nanoparticules de contrôle sont rapidement capturées par les macrophages, tandis que les nanoparticules avec une identité biologique non autonome sont efficacement séquestrées par les cellules endothéliales piégeuses. Crédit :Yuya Hayashi. Adapté de Mohammad-Beigi et al. (2020) ACS Nano. Copyright 2020 Société chimique américaine
Une variété de nanoparticules sont conçues pour une administration ciblée de médicaments, mais malheureusement, seule une très faible proportion des nanoparticules injectées atteint le site cible comme les tumeurs solides. La raison de la faible efficacité du ciblage est souvent considérée comme une "boîte noire" et a donc été peu explorée depuis de nombreuses années.
Récemment, une équipe de recherche internationale dirigée par Yuya Hayashi du Département de biologie moléculaire et de génétique (MBG), Université d'Aarhus, a démontré la beauté des embryons de poisson zèbre en nano-bioimagerie qui permet de visualiser les interactions dynamiques entre les nanoparticules et les cellules d'intérêt dans un organisme vivant (voir un autre article "Le poisson zèbre vous permet de voir le destin biologique des nanoparticules in vivo").
Maintenant, en collaboration avec des chercheurs du Centre interdisciplinaire de nanosciences (iNANO), Yuya cherche à répondre aux mystères non résolus de la bionanoscience - le premier en ligne est le concept d'identité biologique, ce qui explique comment les cellules reconnaissent les nanoparticules grâce à une « couronne » de protéines qui entourent chaque particule. Ce concept a maintenant été prouvé pour la première fois dans un organisme vivant par l'utilisation d'embryons de poisson zèbre découvrant ce qu'il advient des nanoparticules injectées dans le sang.
Ami ou ennemi? Comment les systèmes biologiques reconnaissent les nanoparticules
"What the Cell Sees in Bionanoscience" est l'une des premières publications qui ont défini comment une couronne de protéines se forme autour d'une nanoparticule et comment une telle couronne de protéines implique la nécessité de repenser la façon dont nous regardons les nanoparticules dans un milieu biologique. D'après des recherches approfondies au cours de la dernière décennie, nous comprenons maintenant que deux effets opposés contribuent principalement à l'absorption des nanoparticules par les cellules. En général, la couronne protéique empêche la surface des nanoparticules d'interactions physiques directes avec la membrane cellulaire. Cependant, Et si la couronne protéique présentait un signal qui déclenche une interaction biologique spécifique avec des récepteurs déployés sur la membrane cellulaire ? C'est quelque chose que la cellule voit et confère ainsi une identité biologique à la nanoparticule.
Les chercheurs de l'Université d'Aarhus ont ainsi fourni la première preuve "visuelle" de la contribution frappante de la couronne protéique à l'élimination des nanoparticules du sang qui a entraîné des résultats indésirables dans le modèle d'embryon de poisson zèbre. L'équipe de recherche a utilisé une source de protéines incompatible avec l'espèce pour la formation de la couronne afin de créer une identité biologique « non-soi » et a retracé le parcours des nanoparticules voyageant dans le sang et jusqu'à leur destination finale :les endolysosomes dans la cellule. Cela a révélé une absorption et une acidification étonnamment rapides des nanoparticules par les cellules endothéliales charognardes (équivalent fonctionnel des cellules endothéliales sinusoïdales du foie chez les mammifères) suivies d'une activation pro-inflammatoire des macrophages (voir le film présenté sur la page Web du groupe de Yuya).
"Cela semble une idée folle d'injecter des nanoparticules avec des protéines d'un autre animal, " dit Yuya, "mais par exemple, les nanomédicaments inspirés des biomolécules sont testés dans un modèle murin sans souci particulier pour la combinaison d'espèces incompatibles. Ou bien des gens intelligents humanisent la souris pour s'occuper du problème de compatibilité des espèces. En réalité, même au niveau de la culture cellulaire, les nanoparticules sont toujours testées en routine suivant la tradition d'utiliser un supplément de sérum dérivé de vaches tout en sachant que les interactions nanoparticule-protéine sont un facteur clé de l'absorption cellulaire. »
"Ce qui rend ce genre d'expériences assez difficile, c'est " ajoute le premier auteur Hossein Mohammad-Beigi, "pour conserver au maximum la couronne protéique d'origine dans un organisme vivant. Si la couronne préformée est rapidement échangée par des protéines sanguines endogènes, l'hypothèse testée devient invalide. Nous avons fait pas mal d'efforts pour caractériser la couronne protéique afin de garantir que les nanoparticules préservent l'identité biologique non-soi. »
Voir c'est croire - le modèle du poisson zèbre peut offrir ce que les modèles de rongeurs ne peuvent pas
Le plus grand avantage du modèle de poisson zèbre est sa puissance en imagerie multicolore en temps réel, grâce à quoi de multiples combinaisons de traceurs de fluorescence et de protéines rapporteurs peuvent être imagées dans une configuration simple à haute résolution spatio-temporelle. Cela offre une nouvelle opportunité qui se situe entre des systèmes de culture cellulaire moins réalistes et des expériences plus difficiles sur des rongeurs telles que la microscopie intravitale.
« À l'aide de cultures cellulaires, nous avons beaucoup appris sur la façon dont les cellules reconnaissent les nanoparticules plutôt comme des agrégats dynamiques de protéines, mais cela n'a jamais été testé dans une situation plus réaliste, " explique Yuya. " Avec la mise en place du modèle du poisson zèbre, nous avons enfin acquis un moyen d'approfondir cette question dans un organisme vivant. C'était une approche simple avec un scénario extrême testé dans un système très complexe, mais je pense que nous sommes maintenant un pas de plus vers la compréhension de ce que la couronne protéique peut réellement signifier pour les nanoparticules. Dans un environnement riche en protéines, les nanoparticules peuvent porter un masque qui leur confère une identité biologique, et son non-soi peut en faire un ennemi. Qu'est-ce qui définit le degré du non-soi ? Bien, c'est la prochaine grande question à laquelle nous devons répondre."