La délivrance intracellulaire de protéines est une technique importante pour dévoiler les fonctions cellulaires, la structure du complexe protéique et les agents thérapeutiques. Cependant, les méthodes de livraison conventionnelles présentent plusieurs limites.
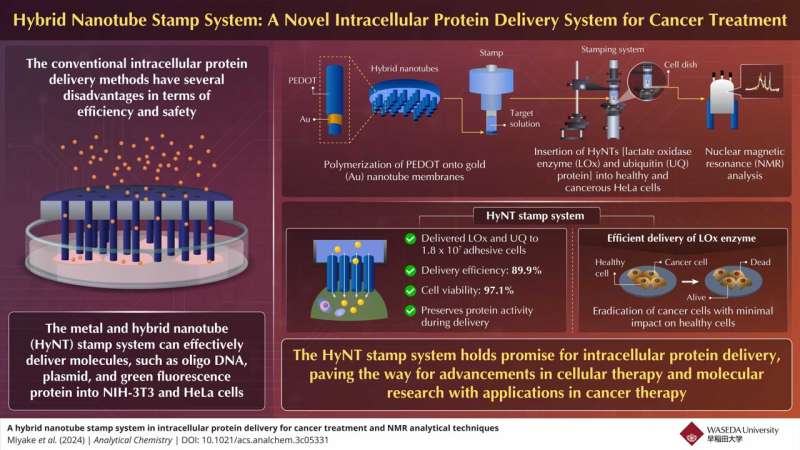
Pour résoudre ce problème, des chercheurs japonais ont développé un nouveau système de tampons à nanotubes hybrides (HyNT) capable de fournir plusieurs protéines avec des taux d'efficacité et de viabilité élevés. Ce système représente une avancée dans l'administration intracellulaire de protéines, offrant une injection précise d'agents thérapeutiques dans les cellules cibles.
Dans le paysage médical actuel, la médecine de précision et les thérapies ciblées gagnent du terrain grâce à leur capacité à adapter les traitements à chaque patient tout en minimisant les effets indésirables.
Les méthodes conventionnelles, telles que les techniques de transfert de gènes, s'avèrent prometteuses pour administrer des gènes thérapeutiques directement aux cellules afin de traiter diverses maladies. Cependant, ces méthodes se heurtent à des inconvénients importants, qui entravent leur efficacité et leur sécurité.
La délivrance intracellulaire de protéines offre une approche prometteuse pour développer des thérapies plus sûres, plus ciblées et plus efficaces. En transférant directement les protéines dans les cellules cibles, cette méthode évite des problèmes tels que le silence lors de la transcription et de la traduction et le risque de mutations indésirables liées à l'insertion de l'ADN. De plus, l'administration intracellulaire de protéines permet une distribution précise des protéines thérapeutiques dans les cellules cibles sans provoquer de toxicité.
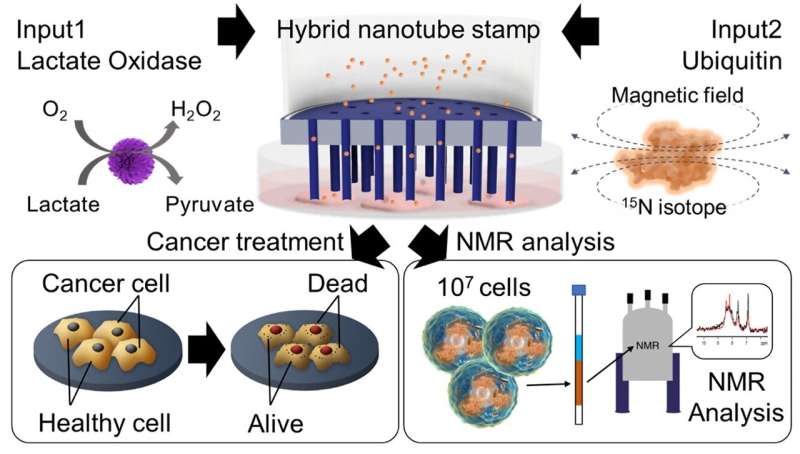
Un groupe de chercheurs dirigé par le professeur Takeo Miyake de l'Université Waseda au Japon, en collaboration avec le groupe Mikawa de l'Institut RIKEN, a développé un système hybride de tampons à nanotubes pour la délivrance intracellulaire de protéines. Cette technique innovante permet l'administration simultanée de diverses cargaisons, notamment du colorant calcéine, de l'enzyme lactate oxydase (LOx) et de la protéine ubiquitine (UQ), directement dans les cellules adhésives pour le traitement du cancer.
Un article décrivant la recherche est publié dans Analytical Chemistry. . Cet article a été co-écrit par le Dr Tsutomu Mikawa, le Dr Masaomi Ikari, le Dr Hiromasa Yagi, le Dr Naoya Tochio et le Dr Takanori Kigawa du Centre RIKEN pour la recherche sur la dynamique des biosystèmes, Japon et M. Bowen Zhang, M. Bingfu Liu, M. Zhouji Wu et M. Kazuhiro Oyama de l'Université Waseda, Japon.
Miyake explique brièvement l'assemblage du système de tampon. "Les HyNT ont été synthétisés par polymérisation PEDOT sur des membranes de nanotubes d'Au, puis assemblés avec un tube de verre pour créer un tampon capable d'insérer physiquement les HyNT dans les cellules."
Les chercheurs ont exploré le potentiel thérapeutique de l’administration de l’enzyme LOx pour le traitement du cancer. « Grâce à notre système de tampon innovant, nous avons réussi à administrer du LOx à la fois à des cellules souches mésenchymateuses (CSM) saines et à des cellules HeLa cancéreuses. Bien que les cellules MSC ne soient pas affectées, nous avons observé une mort cellulaire significative dans les cellules cancéreuses HeLa après un traitement par LOx, avec une viabilité diminuant avec le temps.
"Nos résultats mettent en évidence l'efficacité prometteuse du LOx administré par voie intracellulaire pour cibler et tuer sélectivement les cellules cancéreuses, tout en épargnant les cellules saines, offrant ainsi une stratégie thérapeutique ciblée pour le traitement du cancer", explique Miyake.
Finalement, l'équipe a livré avec succès 15 Protéines UQ marquées par un isotope N dans des cellules HeLa à l’aide du système de tampon HyNT. Cette livraison a permis l'analyse de structures protéiques complexes et d'interactions au sein des cellules.
De plus, l'imagerie optique et de fluorescence a confirmé la présence d'UQ délivrée dans les cellules HeLa, et la spectroscopie de résonance magnétique nucléaire a fait correspondre la concentration intracellulaire de protéine UQ avec celle d'une solution contenant 15 . UQ marqué N.
Ces résultats démontrent l'efficacité du système Stamp dans la délivrance de protéines cibles pour une analyse ultérieure.
Les résultats démontrent la capacité remarquable du système de tampon HyNT à délivrer LOx et UQ dans un nombre important de cellules adhésives, comme l'exigent les applications de médecine régénérative.
Le système a atteint une efficacité de délivrance particulièrement élevée de 89,9 %, indiquant son efficacité à transporter avec précision les protéines thérapeutiques dans les cellules cibles. De plus, le taux de viabilité cellulaire de 97,1 % met en évidence la capacité du système à maintenir la santé et l'intégrité des cellules traitées tout au long du processus de livraison.
Le système HyNT stamp offre un potentiel transformateur dans l’administration intracellulaire de protéines, avec des applications allant du traitement du cancer à l’analyse moléculaire. Au-delà de la médecine, sa polyvalence s'étend aux industries agricoles et alimentaires, promettant des progrès dans la production végétale et le développement de produits alimentaires.
Grâce à une manipulation cellulaire précise et à une administration efficace, le système de tampons HyNT est sur le point de révolutionner la recherche biomédicale, la pratique clinique et diverses industries, ouvrant la voie à des interventions personnalisées et façonnant l'avenir de la médecine moderne.
Plus d'informations : Bowen Zhang et al, Un système hybride de tampons à nanotubes pour l'administration de protéines intracellulaires pour le traitement du cancer et les techniques analytiques RMN, Chimie analytique (2024). DOI :10.1021/acs.analchem.3c05331
Informations sur le journal : Chimie analytique
Fourni par l'Université Waseda