Une collaboration interdisciplinaire a conçu un moyen de « dissimuler » les protéines afin qu'elles puissent être capturées par des nanoparticules lipidiques, qui s'apparentent à de minuscules bulles de graisse. Ces bulles sont suffisamment petites pour introduire leur contenu caché dans les cellules vivantes, où les protéines se dévoilent et exercent leur effet thérapeutique.
La technique généralisable pourrait conduire à la réutilisation de milliers de produits protéiques commerciaux, y compris des anticorps, pour la recherche biologique et des applications thérapeutiques.
L'article du groupe, "Bioreversible Anionic Cloaking Enables Intracellulaire Protein Delivery with Ionizing Lipid Nanoparticles", publié le 14 mai dans ACS Central Science . L'auteur principal est le doctorant Azmain Alamgir, qui travaille dans les laboratoires des co-auteurs principaux de l'article, Chris Alabi, professeur agrégé de génie chimique et biomoléculaire à Cornell Engineering, et Matt DeLisa, professeur d'ingénierie William L. Lewis et directeur. de l'Institut Cornell de Biotechnologie.
Le projet a débuté avec un objectif unique :combiner l'expertise du groupe DeLisa dans la conception de produits thérapeutiques à base de protéines avec l'accent mis par le laboratoire Alabi sur l'administration intracellulaire de produits biologiques.
Pour que certains médicaments aient un impact sur la biologie d'une cellule et, à terme, traitent une maladie, ils doivent pénétrer à l'intérieur de la cellule et atteindre un espace spécifique. Ceci est similaire à la réparation d'un tuyau cassé dans une maison :le plombier doit accéder à une pièce particulière pour réparer la fuite.
Les thérapies à base de protéines ont de nombreuses vertus – elles peuvent avoir des effets plus spécifiques, avec une toxicité moindre et une réponse immunitaire diminuée – mais la facilité d’administration n’en fait pas partie. Les protéines sont volumineuses et encombrantes et ne se diffusent pas librement dans les cellules aussi facilement que les petites molécules. C'est l'une des raisons pour lesquelles les petites molécules constituent la source prédominante de médicaments dans l'industrie pharmaceutique :elles peuvent facilement se diffuser dans les cellules sans véhicule de diffusion.
Au fil des années, le groupe de DeLisa a développé une large gamme de candidats médicaments protéiques intéressants et potentiellement efficaces. Malheureusement, l’utilité pratique de ces protéines était limitée par l’absence de méthode de délivrance intracellulaire. Même si la thérapie génique, une technologie biomédicale capable de produire un effet thérapeutique en délivrant un gène destiné à être exprimé dans des cellules cibles, était une option, cette méthode a une histoire mouvementée, en raison de problèmes de sécurité chez l'homme.
"Nous recherchions un moyen intelligent d'introduire efficacement nos protéines modifiées à l'intérieur des cellules, en particulier dans un contexte translationnel qui fonctionnerait non seulement dans des cellules cultivées en laboratoire, mais qui serait également efficace et sûr dans des modèles animaux et éventuellement chez l'homme. ", a déclaré DeLisa.
"Lorsque Azmain a connecté notre groupe à celui de Chris, l'une des idées qui a fait surface était la suivante :pourquoi proposer cela sous forme de thérapie génique alors que nous pourrions le proposer sous forme de protéine déjà fabriquée ? Et cela nous a vraiment enthousiasmés."
Le laboratoire d'Alabi était confronté à ses propres défis. Même si l'équipe avait de l'expérience dans l'administration d'acides nucléiques dans les cellules à l'aide de nanoparticules, a déclaré Alabi, elle n'avait pas encore trouvé le moyen de faire de même avec des « protéines molles globulaires spongieuses » en raison de l'expérience limitée du laboratoire dans la production de quantités suffisantes de protéines pour les tests.
"Nous avons vu cela comme un joli pont entre nos groupes de recherche, pour créer ce nouvel espace sur lequel je ne pense pas que beaucoup de gens travaillaient à l'époque et le faire d'une manière qui pourrait être évolutive et percutante", a déclaré Alabi. .
Les chercheurs ont eu l’idée générale d’utiliser une approche de bioconjugaison qui permettrait de charger les protéines dans des nanoparticules lipidiques, qui se forment autour des acides nucléiques. L'un des principaux avantages de cette approche était que les nanoparticules lipidiques constituaient un élément clé du succès des vaccins contre la COVID-19 développés par Pfizer-BioNTech et Moderna.
"À l'époque, cette technologie était vraiment en plein essor", a déclaré Alamgir.
Ces vaccins fonctionnaient en délivrant une charge utile sous forme d’ARN messager, qui sont des acides nucléiques. Les chercheurs utiliseraient désormais le même concept de délivrance de nanoparticules lipidiques – voire les mêmes matériaux – mais avec une charge utile protéique. L'astuce serait de faire en sorte que les protéines ressemblent davantage à des acides nucléiques.
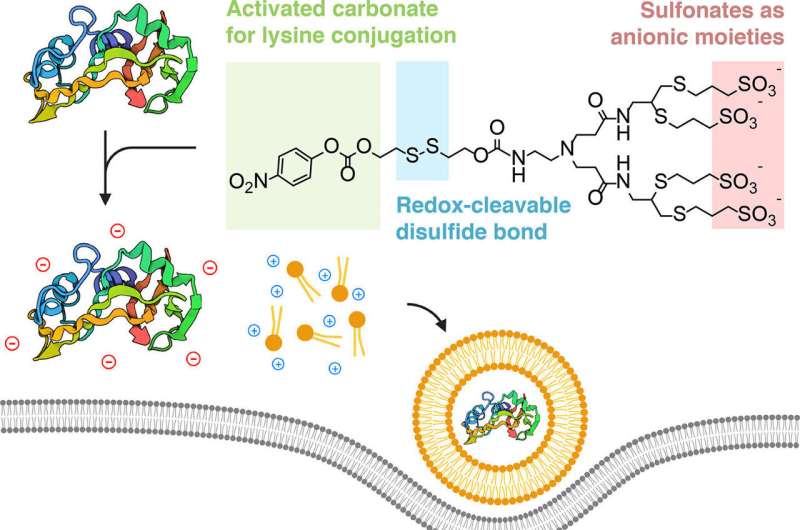
Les chercheurs ont découvert qu'ils pouvaient y parvenir en « masquant » les protéines avec un ion chargé négativement, afin qu'elles se joignent électrostatiquement aux lipides chargés positivement.
"Le point crucial de notre stratégie est conceptuellement très simple", a déclaré Alamgir. "Nous prenons des protéines et remodelons spécifiquement leurs surfaces avec des charges négatives, afin qu'elles ressemblent à des acides nucléiques et puissent de la même manière s'assembler en nanoparticules lorsqu'elles sont formulées avec les lipides caractéristiques."
L'une des difficultés rencontrées par l'équipe était que les conditions dans lesquelles les acides nucléiques sont formulés pour se lier ou se complexer aux lipides sont assez dures, trop dures pour les protéines.
"Nous avons dû utiliser des conditions plus douces et une formulation légèrement modifiée dans laquelle nous avons ajouté des lipides supplémentaires", a déclaré Alabi. "Donc, tant du côté de la bioconjugaison des protéines que du côté des lipides, nous avons dû modifier la formulation pour que cela fonctionne aussi bien."
L'équipe, qui comprenait le doctorant et co-auteur Souvik Ghosal, a démontré avec succès la méthode de masquage avec des composés sulfonés réactifs à la lysine, tuant les cellules cancéreuses avec la ribonucléase A et inhibant la signalisation tumorale avec des anticorps monoclonaux d'immunoglobuline G (IgG).
Un avantage supplémentaire de la chimie de bioconjugaison utilisée par l’équipe est que le processus est réversible. L'étiquette chimique ajoutée à la protéine se détache une fois entrée dans le cytoplasme de la cellule. Et comme la méthode de bioconjugaison cible la lysine, un type d'acide aminé présent en abondance dans les protéines naturelles, la technique peut être reproduite pour pratiquement n'importe quelle protéine.
"Cela pourrait permettre de prendre un grand nombre de protéines disponibles dans le commerce actuellement disponibles auprès de nombreux distributeurs des sciences de la vie et sociétés de biotechnologie et de les réutiliser pour de nouvelles applications intracellulaires", a déclaré Alamgir.
Plus d'informations : Azmain Alamgir et al, L'occultation anionique bioréversible permet l'administration intracellulaire de protéines avec des nanoparticules lipidiques ionisables, ACS Central Science (2024). DOI :10.1021/acscentsci.4c00071
Informations sur le journal : Science centrale de l'ACS
Fourni par l'Université Cornell