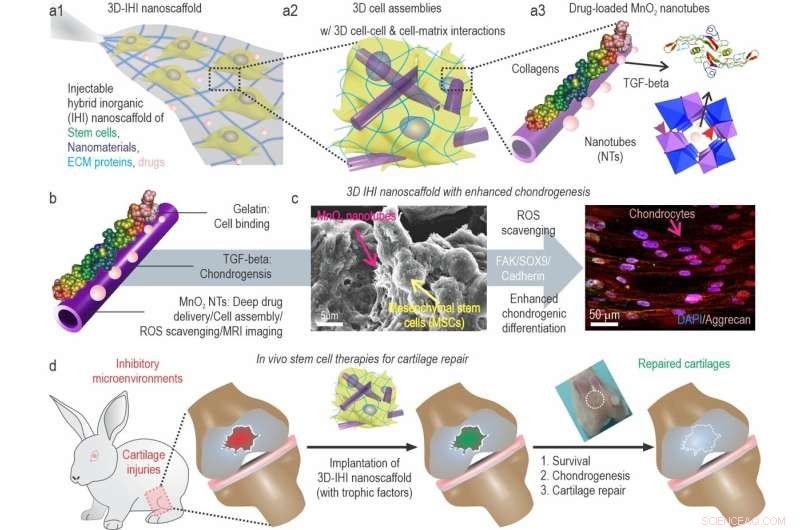
a) Une illustration schématique du nanoéchafaudage 3D TGFβ-BMSC-IHI. b) L'illustration schématique du MnO2 enrobé de gélatine et chargé de TGF-β3 NT. c) L'image FESEM a indiqué que la plupart des BMSC forment des contacts avec d'autres cellules et les structures ressemblant à des fibrilles 1D, qui étaient similaires aux structures des tissus naturels. d) En remodelant le microenvironnement oxydatif, en améliorant la viabilité cellulaire et la chondrogenèse des cellules transplantées, la régénération du cartilage pourrait enfin être réalisée. Crédit :Science China Press
Une étude dirigée par le professeur Qiuyu Zhang (Northwestern Polytechnical University), le professeur Ki-Bum Lee (Rutgers University) et le professeur Liang Kong (School of Stomatology, The Fourth Military Medical University) a établi un hybride inorganique injectable (IHI) assemblage de cellules souches à base de nanoéchafaudage et l'a appliqué à la régénération de défauts cartilagineux de taille critique.
Les lésions du cartilage sont souvent dévastatrices et la plupart d'entre elles sont incurables en raison de la capacité de régénération intrinsèquement faible des tissus cartilagineux. L'essor des systèmes de culture de cellules souches 3D a conduit à des percées dans la biologie du développement, la modélisation des maladies et la médecine régénérative. Par exemple, les cellules souches, une fois transplantées avec succès, pourraient initialement sécréter des facteurs trophiques pour réduire l'inflammation au niveau des lésions du cartilage, puis se différencier en cellules cartilagineuses (par exemple, les chondrocytes) pour une restauration fonctionnelle.
Néanmoins, il reste des obstacles critiques à surmonter avant que le potentiel thérapeutique des thérapies à base de cellules souches puisse être réalisé. Le contrôle limité de la différenciation chondrogénique des cellules souches in vivo a souvent entraîné des résultats de régénération compromis. De plus, en raison de la prévalence du stress oxydatif et de l'inflammation dans le microenvironnement des sites de lésions, les cellules souches subissent fréquemment une apoptose après injection.
Pour relever ces défis, les chercheurs ont démontré le développement d'un système d'assemblage de cellules souches à base de nanoéchafaudage 3D IHI pour la culture et l'implantation avancées de cellules souches 3D. Le nanoéchafaudage 3D-IHI assemble rapidement des cellules souches dans des constructions tissulaires injectables grâce à des interactions cellule-cellule et cellule-matrice 3D personnalisées, délivre de manière profonde et homogène des protéines chondrogéniques dans les systèmes de culture 3D assemblés et induit de manière contrôlée la chondrogenèse par des effets nanotopographiques.
Une fois implanté in vivo dans un modèle de lésion du cartilage de lapin, le nanoéchafaudage 3D-IHI module efficacement le microenvironnement dynamique après une lésion du cartilage grâce à l'intégration des signaux régénératifs susmentionnés, et élimine simultanément les espèces réactives de l'oxygène à l'aide d'une composition à base de dioxyde de manganèse. De cette manière, une réparation accélérée des défauts du cartilage avec une reconstruction tissulaire rapide et une récupération fonctionnelle est réalisée à la fois à court et à long terme. Compte tenu de l'excellente polyvalence et des résultats thérapeutiques de la régénération du cartilage à base de nanoéchafaudage 3D-IHI, il peut fournir des moyens prometteurs pour faire progresser une variété d'applications d'ingénierie tissulaire.
La recherche a été publiée dans National Science Review .
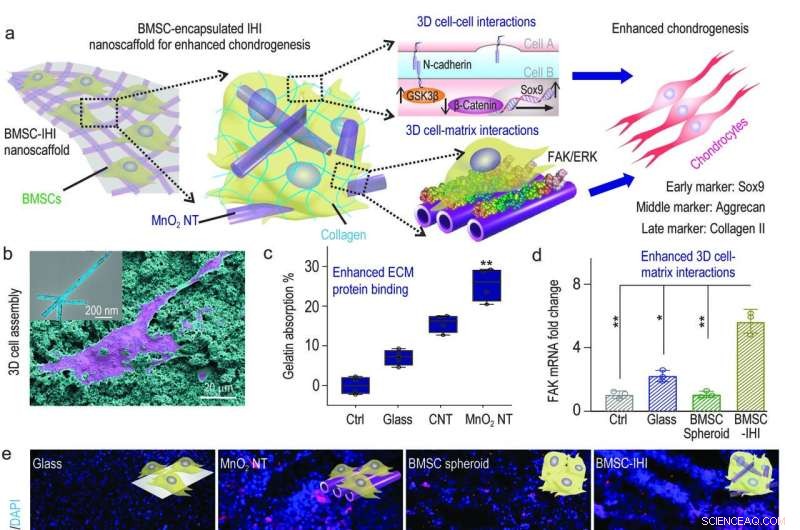
a) Un diagramme schématique montrant le nanoéchafaudage 3D-IHI pourrait améliorer la différenciation chondrogénique du BMSC grâce à une synergie entre les voies médiées par la N-cadhérine et la FAK. b) Les interactions fortes entre MnO2 Les NT et les groupes fonctionnels existant couramment dans les protéines ECM ont efficacement soutenu l'attachement cellulaire, comme le montre l'image SEM. c) Le dosage de l'acide bicinchoninique a indiqué l'absorption accrue vers la gélatine à partir de MnO2 nanotube par rapport aux groupes témoins. d) Le MnO2 nanotube-templated assembly method significantly enhanced cell-matrix interaction as demonstrated through the up-regulated expression patterns of the FAK gene. e) Representative immunostaining images showing the improved chondrogenesis of BMSC in the BMSC-IHI nanoscaffold group compared to the control groups. Barre d'échelle :50 μm. f-h) The expression of chondrogenic genes, including SOX9 (f), Aggrecan (g), and Col-II (h) were characterized via qRT-PCR measurement. Crédit :Science China Press
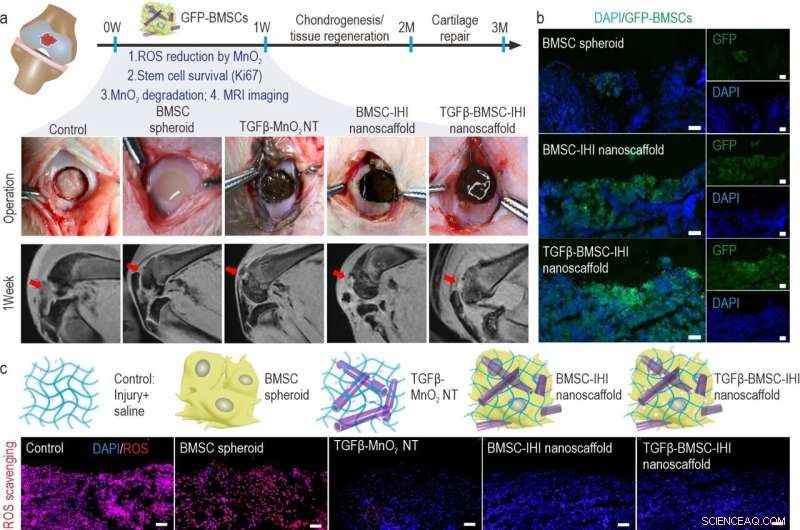
a) Schematic diagram illustrating the surgical process and timeline of cartilage repair. The degradation of MnO2 NTs and the regeneration process could be monitored via MRI. b) To identify our transplanted cells, BMSCs were genetically labeled with a green fluorescent protein (GFP). Scale bar:100 μm. c) The dramatically reduced red fluorescent signals of the ROS probe revealed that MnO2 NTs in the IHI nanoscaffold could effectively scavenge ROS in the defect area. Promoted cell proliferation was confirmed by the higher expression of proliferative marker Ki67 immunostaining. Barre d'échelle :50 μm. d) The TGFβ-BMSC-IHI nanoscaffold could retain a significantly higher amount of cells after transplantation compared to other cell transplantation groups by quantifying the number of remaining GFP+ cells in (c). e) Histogram of the fluorescence intensity of ROS probe showed the effective consumption of ROS in the MnO2 NTs containing groups. f) Quantification of Ki67+ cells in the defects. The quantifications in (e) and (f) were generated based on the fluorescence intensities in (c). Crédit :Science China Press
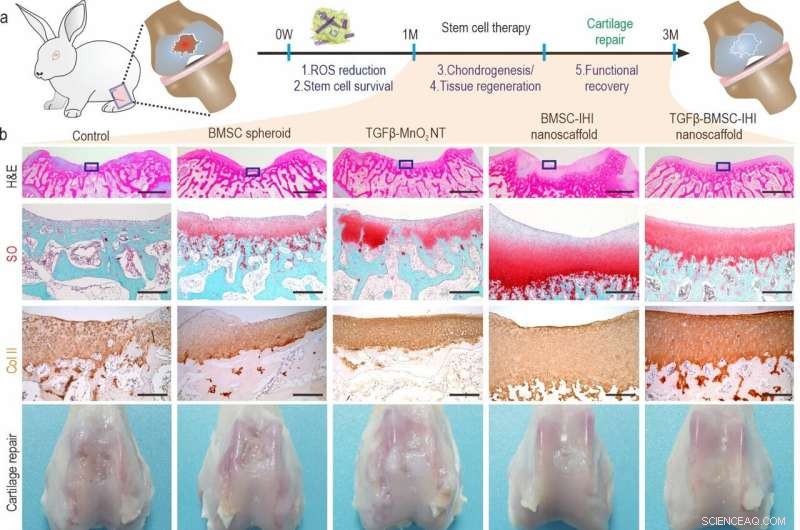
a) A schematic diagram illustrating the long-term (3 months) cartilage regeneration process. b) The in vivo cartilage regeneration was characterized through H&E, Safranin O staining, Col-II immunochemistry staining, as well as macroscopic views. Zoom out scale bar:2 mm, zoom in scale bar:200 μm. c-h) Quantifications of cartilage thickness (by H&E staining) (c), cellular components (by Safranin O staining) (d), ECM components (by Col II immunostaining) (e). Results of International Cartilage Repair Society (ICRS) macroscopic (f) and histologic scores (g) indicated significantly improved defect repair qualities in the TGFβ-BMSC-IHI nanoscaffold group. The reduced Osteoarthritis Research Society International (OARSI) scores revealed the TGFβ-BMSC-IHI nanoscaffold could prevent the deterioration of osteoarthritis (h). Crédit :Science China Press