Crédit :Université Lehigh
Le cancer de l'ovaire tue 14 000 femmes aux États-Unis chaque année. C'est la cinquième cause de décès par cancer chez les femmes, et c'est si mortel, en partie parce que la maladie est difficile à attraper à ses débuts. Souvent, les patients ne présentent pas de symptômes tant que le cancer n'a pas commencé à se propager, et il n'existe aucun test de dépistage fiable pour une détection précoce.
Une équipe de chercheurs travaille à changer cela. Le groupe comprend des chercheurs du Memorial Sloan Kettering Cancer Center, de Weill Cornell Medicine, de l'Université du Maryland, des National Institutes of Standards and Technology et de l'Université de Lehigh.
Deux articles récents décrivent leurs progrès vers une nouvelle méthode de détection du cancer de l'ovaire. L'approche utilise des techniques d'apprentissage automatique pour analyser efficacement les signatures spectrales des nanotubes de carbone afin de détecter les biomarqueurs de la maladie et de reconnaître le cancer lui-même.
Le premier article est paru dans Science Advances en novembre.
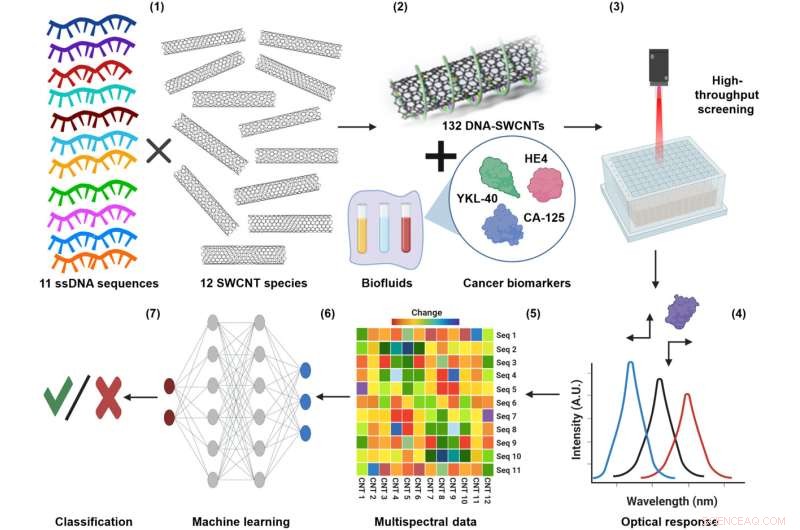
"Nous avons démontré qu'une plate-forme de nanocapteurs basée sur la perception pouvait détecter les biomarqueurs du cancer de l'ovaire à l'aide de l'apprentissage automatique", déclare Yoona Yang, associée de recherche postdoctorale au département de génie chimique et biomoléculaire de Lehigh et co-première auteure de l'article avec Zvi Yaari, postdoctorale chercheur au Memorial Sloan Kettering Cancer Center à New York. Les auteurs comprenaient également Ming Zheng, chimiste chercheur à l'Institut national des normes et de la technologie, Anand Jagota, professeur de bio-ingénierie et de génie chimique et biomoléculaire à l'Université de Lehigh, et Daniel Heller, membre associé et directeur du Laboratoire de nanotechnologie du cancer au Memorial Centre de cancérologie Sloan Kettering.
Jagota, qui est également doyen associé de la recherche au Lehigh's College of Health, et Yang sont membres de Lehigh's Nano | Human Interfaces Presidential Initiative, une initiative de recherche multidisciplinaire qui vise à changer la façon dont nous travaillons avec les données et les instruments sophistiqués de la découverte scientifique.
Traditionnellement, la détection des biomarqueurs de la maladie nécessite une molécule de reconnaissance moléculaire comme un anticorps à associer à chaque marqueur. Mais pour le cancer de l'ovaire, il n'y a pas un seul biomarqueur - ou analyte - qui indique la présence d'un cancer. Lorsque plusieurs analytes doivent être mesurés dans un échantillon donné, ce qui peut augmenter la précision d'un test, davantage d'anticorps sont nécessaires, ce qui augmente le coût du test et le délai d'exécution.
"La détection basée sur la perception fonctionne comme le cerveau humain", explique Yang. "Le système se compose d'un réseau de détection qui capture une certaine caractéristique des analytes d'une manière spécifique, puis la réponse d'ensemble du réseau est analysée par le modèle perceptif informatique. Il peut détecter plusieurs analytes à la fois, ce qui le rend beaucoup plus efficace."
Pour cette étude particulière, le réseau était composé de nanotubes de carbone à paroi unique enveloppés dans des brins d'ADN. La manière dont l'ADN était enveloppé et la variété des séquences d'ADN utilisées ont créé une diversité de surfaces sur les nanotubes. Les diverses surfaces, à leur tour, ont attiré une gamme de protéines dans un échantillon de lavage utérin enrichi de différents niveaux de biomarqueurs du cancer de l'ovaire.
"Les nanotubes de carbone ont des propriétés électroniques intéressantes", explique Heller. "Si vous leur tirez dessus, ils émettent une couleur de lumière différente, et la couleur et l'intensité de cette lumière peuvent changer en fonction de ce qui adhère au nanotube. Nous avons pu exploiter la complexité de tant d'interactions de liaison potentielles en utilisant une gamme de nanotubes avec divers emballages. Et cela nous a donné une gamme de capteurs différents qui pouvaient tous détecter des choses légèrement différentes, et il s'est avéré qu'ils réagissaient différemment à différentes protéines."
L'algorithme d'apprentissage automatique a été formé à l'aide des données de l'émission de nanotubes (les signatures spectrales) pour reconnaître le schéma d'émission qui signalait la présence et la concentration de chaque biomarqueur.
"La percée mentale ici est que ces nanotubes sont des capteurs non spécifiques", explique Jagota. "Ils ne savent rien des biomarqueurs, ce qui signifie qu'ils ne sont pas programmés pour se lier à quelque chose de spécifique. Tout ce que nous savions, c'est qu'ils peuvent être exposés à un milieu aqueux, et tout ce à quoi ils sont exposés dans ce milieu produira des décalages spectraux. et les changements d'amplitude. Et en utilisant une combinaison de ces capteurs, nous avons pu former l'algorithme pour transformer mathématiquement ces entrées en sorties avec une grande précision. C'est comme avoir 20 paires d'yeux qui voient tous des choses qui se chevauchent. Aucun œil n'est aussi bon , mais en tant que collection, ils peuvent être entraînés pour être plus performants que les méthodes de détection existantes du cancer de l'ovaire."
Le deuxième article est paru en mars dans Nature Biomedical Engineering et comprenait le travail de plusieurs des mêmes chercheurs. En outre, les auteurs comprenaient YuHuang Wang, professeur au département de chimie et de biochimie de l'Université du Maryland, et Mijin Kim, associé de recherche postdoctoral au Memorial Sloan Kettering Cancer Center, qui était l'auteur principal de l'étude.
"Dans cet article, nous ne regardions plus les biomarqueurs, nous regardions la maladie elle-même", explique Heller. « Nous voulions savoir si cette technologie pouvait différencier un échantillon de sang d'une patiente atteinte d'un cancer de l'ovaire d'une patiente sans cancer de l'ovaire ?
Ces patients sans cancer de l'ovaire comprenaient à la fois des personnes en bonne santé et des personnes atteintes d'autres maladies.
Dans cette étude, les nanotubes ont été fonctionnalisés avec des défauts quantiques, ce qui a essentiellement augmenté la diversité des réponses que les nanotubes fourniraient.
"Les nanotubes étaient liés à une certaine molécule qui lui donnait un signal supplémentaire en termes de données", explique Jagota. "Donc, des données plus riches provenaient de chaque combinaison nanotube-ADN. Et le modèle a été formé non pas sur le biomarqueur, mais sur l'état de la maladie."
Le modèle a développé une "empreinte digitale de la maladie" à partir des émissions spectrales des nanotubes. Les résultats étaient statistiquement significatifs en termes de spécificité du modèle dans la détection du cancer de l'ovaire et de sensibilité dans la détection des biomarqueurs connus et inconnus de la maladie.
Heller dit qu'une analogie pour le fonctionnement du modèle d'apprentissage automatique - dans les deux articles - est le nez humain. Par exemple, il n'y a pas un seul récepteur d'odeur pour chaque odeur.
"Au lieu de cela, il existe un tas de récepteurs d'odeurs différents qui se lient à certaines molécules et créent un motif ou une sorte d'empreinte digitale", dit-il. "Et ce modèle est traité par votre cerveau, qui à son tour, vous dit ce que vous sentez. Donc ici, il n'y a pas un capteur particulier qui répond à une chose particulière. Mais, sur la base du modèle de différents capteurs répondant à divers changements en couleur et en intensité de longueur d'onde, l'algorithme est capable d'interpréter ce qui est un biomarqueur et ce qui ne l'est pas, ou ce qui est une maladie et ce qui n'est pas une maladie."
L'équipe a montré que sa technique peut détecter le cancer de l'ovaire mieux que les méthodes actuelles, mais elle ne peut pas encore identifier les premiers stades de la maladie. En partie, dit Heller, le problème est de trouver suffisamment d'échantillons pour entraîner l'algorithme, car si peu de personnes sont diagnostiquées à ces moments-là.
"Nous travaillons à déterminer comment nous pouvons réellement détecter cette maladie le plus tôt possible", dit-il.
Les prochaines étapes pourraient également consister à se diversifier pour développer la technique pour une gamme de maladies et à déterminer si elle peut être optimisée pour fonctionner dans des conditions cliniques, déclare Jagota.
"Et c'est une technique qui peut être appliquée dans une gamme de domaines", dit-il. "Nous nous concentrons sur la santé, mais cela pourrait être utilisé pour identifier les polluants dans l'air, par exemple. Il y a le potentiel de s'attaquer à de nombreuses maladies et conditions différentes, et je trouve cela fascinant." Des chercheurs utilisent des sondes fluorescentes à base de nanotubes de carbone pour détecter le cancer de l'ovaire