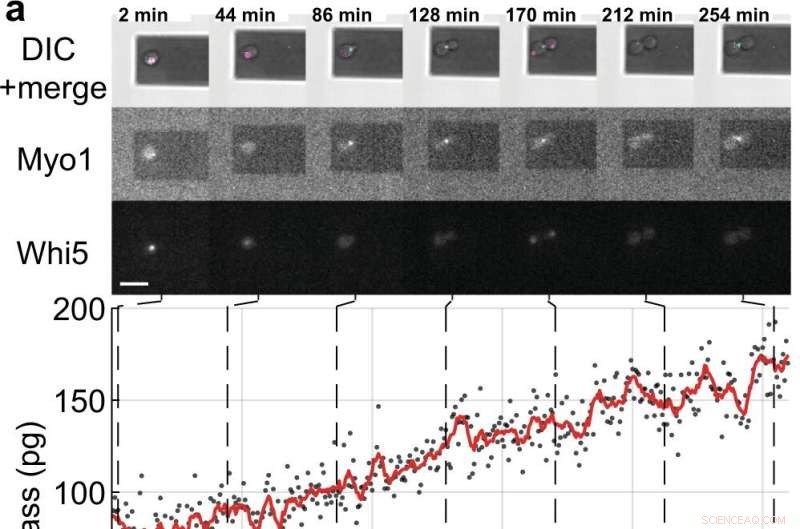
Mesures de la masse et du cycle cellulaire de cellules filles uniques en herbe de S. cerevisiae. a, b Des cellules de levure individuelles exprimant les protéines marqueurs du cycle cellulaire marquées par fluorescence (Myo1-mKate2 (3 ×) et Whi5-mKOκ (1 ×)), ont été imagées à l'aide d'un contraste interférentiel différentiel (DIC) et d'une microscopie à fluorescence toutes les 2 min (panneaux supérieurs ). Une courbe de phase et d'amplitude du microcantilever a été enregistrée sur des intervalles ≈50 s pour mesurer la masse cellulaire en utilisant le mode balayage (Supplémentaire Film 4). Entre les mesures de masse consécutives, les lasers infrarouges et bleus de la picobalance ont été éteints pendant ≈ 20 s pour réduire le blanchiment des fluorophores et réduire la perturbation potentielle de la croissance des levures. Les valeurs de masse cellulaire dérivées d'ensembles de courbes d'amplitude simples sont représentées par des points gris. Les données brutes moyennes (fenêtre mobile de 350 s, ligne rouge) montrent la tendance. Les barres cyan sur l'axe du temps indiquent la phase S/G2/M du cycle cellulaire de la levure, et les barres magenta indiquent la phase G1. L'étoile (*) en b désigne le détachement (partiel) de la cellule fille après cytokinèse, ce qui fait chuter la masse totale. Barres d'échelle (blanches), 10 µm. c Courbes de croissance de (n =19) cellules de levure individuelles progressant dans la phase S/G2/M (croissance des bourgeons) telles que mesurées par la picobalance en utilisant le mode balayage dans (n =19) expériences indépendantes. Les taux de croissance globaux entre la masse de départ et la masse finale se situent entre 0,1 et 2,0 pg min –1 , avec une moyenne de 0,7 ± 0,5 pg min –1 (moyenne ± SD). La durée de la phase S/G2/M varie de 57 à 184 min, avec une moyenne de 96 ± 35 min. Crédit :Nature Communications (2022). DOI :10.1038/s41467-022-30781-y
Les cellules, les unités de vie les plus fondamentales qui forment tous les organismes vivants, ont longtemps gardé leurs secrets, mais maintenant une équipe internationale de l'Université de Sydney, de l'ETH Zurich et de l'Université de Bâle a découvert certains de leurs secrets grâce au développement d'un monde -première technique.
Les scientifiques savent que les cellules se développent, mais on pensait généralement qu'elles croissent de manière linéaire ou exponentielle avant de se diviser.
Maintenant, dans un article publié dans Nature Communications co-dirigé par le physicien de l'Université de Sydney, le Dr David Martinez-Martin, utilisant une technique de nanotechnologie appelée "picobalance inertielle", les scientifiques ont identifié qu'au niveau de la cellule unique, la levure se développe à intervalles séquentiels ou segments de croissance linéaire (taux de croissance constant) . À chaque intervalle, les cellules de levure passent à une croissance plus rapide ou plus lente, une tendance "en forme d'engrenage".
La recherche a été réalisée avec saccharomyces cerevisiae, un organisme de levure unicellulaire fondamental dans la production de pain, de bière, de vin et de produits pharmaceutiques. Les gènes codant pour les protéines de nombreux types de levures reflètent les gènes des cellules animales, ce qui rend son comportement essentiel pour comprendre les maladies humaines.
Notamment, le comportement trouvé chez la levure diffère significativement de celui des cellules animales (y compris humaines). Ce n'est qu'en 2017 que le Dr Martinez-Martin et ses collègues, utilisant également la picobalance, ont observé pour la première fois que la masse des cellules vivantes de mammifères fluctue de manière intrinsèque :leur taille est "yo-yo".
"We have uncovered processes that challenge models in biology that have been central for decades," said Dr. Martinez-Martin. "The behaviors we have identified in cells from fungus and animal kingdoms provide strong evidence that cells have different strategies to regulate their mass and size, paving the way to better understand how they can accurately form and reform complex structures such as the eyes, brain and fingers in our bodies."
A recent mathematical model published in Journal of Biological Research—Thessaloniki by Dr. Martinez-Martin also offers fresh insight into the meaning of this once-secretive cellular flux.
"Another of our recent studies has found that while cell mass fluctuations have been detected in single mammalian cells, they can be perfectly viable in organisms comprised of many mammalian cells, including humans. Our modeling suggests that the body's cells don't all swell and decrease at the same time—instead they give and take from each other, maintaining an adequate distribution of the body's mass and volume.
"Mass fluctuations may be used by cells to regulate cellular functions such as metabolism, gene expression, proliferation and cell death, by means of altering the concentration and crowdedness of chemical cellular components."
The model also suggests that mass fluctuations allow cells to communicate, both by acting as biomechanical signals through volume fluctuations, and through the exchange of water and molecules.
"I believe this could be a fundamental mechanism which may help cells locate and communicate their position within an organism," Dr. Martinez-Martin said. "Therefore, it could be incredibly important, because it could allow cells to identify and serve their distinct role and purpose in the body."
"Researchers believe that a better understanding of how cells change their mass and size over time, as well as dysregulation of this process (when cells change their size atypically), could be the key to developing the next generation of diagnostics and treatments for a range of diseases, such as cancer, diabetes and cardiovascular disease."
About inertial picobalance:The technique used in the discovery
Dr. Martinez-Martin, who has been recently distinguished by the World Intellectual Property Organization as a young change maker, is the principal inventor of inertial picobalance, a new technology that measures the mass of single or multiple living cells in real-time, enhancing the understanding of cell physiology. The technology is currently being commercialized by the Swiss nanotech company, Nanosurf AG.
In a Nature paper published in 2017, using inertial picoblance, Dr. Martinez-Martin and his colleagues discovered that the mass of living mammalian cells fluctuates intrinsically by one to four percent over seconds, largely due to water entering and exiting cells.
Using this technique, they were also able to observe cells infected with the vaccinia virus (a virus from the poxvirus family). The infected cells showed different mass behavior over time than non-infected cells, potentially enabling a new way of detecting viral infections. Getting bacteria and yeast to talk to each other, thanks to a 'nanotranslator'